题目内容
【题目】火法炼铜是目前世界上最主要的冶炼铜的方法,其产量可占到铜总产量的85%以上,火法炼铜相关的方程式有
Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol 反应①
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g) △H2=+123.2kJ/mol 反应②
(1)Cu2S(s)在空气中煅烧生成Cu2O(s)和SO2(g)的热化学方程式是___。
(2)火法炼铜所得吹炼烟气中SO2含量较高,该烟气在工业上可直接用于生产硫酸,从绿色化学角度考虑其优点有____(任写一条)。
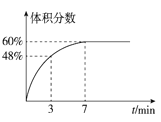
(3)在2L的恒温密闭容器中通入5mol氧气并加入足量Cu2S发生反应①(不考虑其它反应),容器中的起始压强为akPa,反应过程中某气体的体积分数随时间变化如图所示,反应前3min平均反应速率v(SO2)=___mol/(L·min),该温度下反应的平衡常数KP=___(KP为以分压表示的平衡常数)。若保持温度不变向平衡体系中再通入1mol氧气,达到新平衡后氧气的体积分数___(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
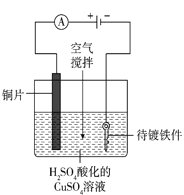
(4)工业上电镀铜的装置如图所示,阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。电镀过程中用空气搅拌而不是氮气搅拌的原因是_____。
【答案】2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-937.4kJ/mol 可减少污染物排放或者原子利用率高 0.4 1.5 等于 氧气可将Cu+氧化为Cu2+以防止镀件表面生成Cu2O
【解析】
(1)根据盖斯定律,2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)为反应①×3-反应②所得,因此△H=3△H1-△H2=-937.4kJ/mol
答案为:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-937.4kJ/mol
(2)吹炼烟气用于生产硫酸可减少SO2的排放;用该烟气生产硫酸的反应为![]()
![]()
![]() 和SO3+H2O=H2SO4,两个反应的原子利用率均为100%。
和SO3+H2O=H2SO4,两个反应的原子利用率均为100%。
答案为:可减少污染物排放或者原子利用率高;
(3)反应①中气体总物质的量始终为5mol,3min时SO2体积分数为48%,c(SO2)=![]() =1.2mol/L,因此v(SO2)=
=1.2mol/L,因此v(SO2)=![]() =0.4mol/(L·min)。体系达平衡时总压强为akPa,O2和SO2的分压分别为0.4akPa和06akPa,KP=
=0.4mol/(L·min)。体系达平衡时总压强为akPa,O2和SO2的分压分别为0.4akPa和06akPa,KP=![]() ,原平衡时氧气的体积分数为40%,根据平衡常数表达式
,原平衡时氧气的体积分数为40%,根据平衡常数表达式![]() ,温度不变,平衡常数不变,增加气体用量,平衡时SO2与O2的物质的量浓度之比保持不变,因此达到新平衡后氧气的体积分数仍为40%。
,温度不变,平衡常数不变,增加气体用量,平衡时SO2与O2的物质的量浓度之比保持不变,因此达到新平衡后氧气的体积分数仍为40%。
答案为:0.4;1.5;等于
(4)阳极产物除Cu2+外还有部分Cu+,部分Cu+经过一系列变化会以Cu2O的形式沉积在镀件表面,导致镀层不够致密、光亮。通入空气可利用氧气将Cu+氧化为Cu2+,可有效预防镀件表面生成Cu2O;
答案为:氧气可将Cu+氧化为Cu2+以防止镀件表面生成Cu2O;