题目内容
| A.107 | B.5.56×108 |
| C.1.0×10-14 | D.55.6 |
B
常温下,c(H+)=1.0×10-7 mol·L-1,即每升水中已电离的水的物质的量是1.0×10-7 mol,而每升水的物质的量是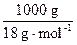 ,则:
,则:
n=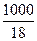 mol∶10-7 mol=5.56×108
mol∶10-7 mol=5.56×108
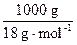 ,则:
,则:n=
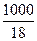 mol∶10-7 mol=5.56×108
mol∶10-7 mol=5.56×108
练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
题目内容
| A.107 | B.5.56×108 |
| C.1.0×10-14 | D.55.6 |
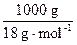 ,则:
,则: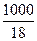 mol∶10-7 mol=5.56×108
mol∶10-7 mol=5.56×108
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案