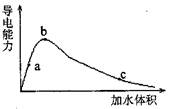
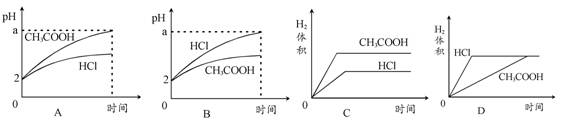
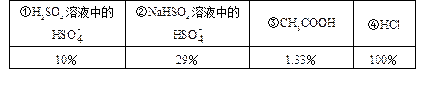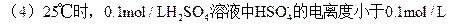题目内容
分别在[H+]=1×10-1摩/升的酸溶液和[OH-]=1摩/升NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
| A.两种溶液的体积相同,酸是多元强酸 |
| B.两种溶液的体积相同,酸是弱酸 |
| C.酸溶液的体积比NaOH溶液的体积大 |
| D.酸是强酸,且酸溶液浓度比NaOH溶液的浓度大 |
B、C
在酸和强碱溶液中,[H+]<[OH-],若为强酸,则放出H2的量不可能比碱多,若使酸放出的气体比碱多,则酸为弱酸,使酸的浓度比碱大,可不断电离产生H+,与Al反应放出的H2量大;酸的体积比碱的体积大,酸的物质的量也可超过碱,也能达到目的。

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目