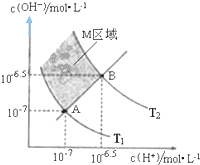
题目内容
| A.自来水 |
| B.0.5 mol·L-1盐酸 |
| C.0.5 mol·L-1 CH3COOH溶液 |
| D.0.5 mol·L-1 KCl溶液 |
B
溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。

练习册系列答案
相关题目