题目内容
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的中性溶液中:Fe3+、Ba2+、NO3-、Cl-
B.使甲基橙变黄色的溶液中: Na+、AlO2-、SO42-、Cl-
C.c(OH–)=1×10-13mol/L的溶液中: NH4+、Ca2+、Cl-、NO3-
D.能使红色石蕊试纸变为蓝色的溶液:Na+、Cl、S2、ClO
【答案】C
【解析】
A.铁离子水解使溶液显酸性,故在中性溶液中不能存在,故错误;
B.甲基橙变黄色的溶液可能酸性或中性或碱性,偏铝酸根离子只能存在于碱性溶液中,故错误;
C.溶液为酸性,四种离子能共存,故正确;
D.溶液为碱性,次氯酸根离子能氧化硫离子,故错误。
故选C。

【题目】下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含所有FeCl3 |
B | CaO | 用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中一定含有SO42- |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
A. A B. B C. C D. D
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有:;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3= , V8=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=(忽略反应前后溶液体积变化).
【题目】某兴趣小组的同学发现,将CuSO4溶液与K2CO3溶液混合会产生蓝绿色沉淀,它们对沉淀的组成和兴趣,决定采用实验大方法进行探究。
(1)【提出猜想】
猜想1:所得沉淀为Cu(OH)2;
猜想2:所得沉淀为______________________;(填化学式)
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2·nCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画)进行定性实验;
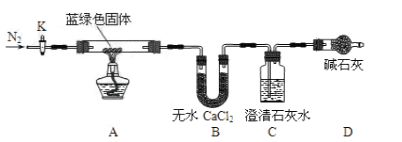
(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_______(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是______________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是__________(填代号)。
溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g·mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为__________;A中发生反应的化学方程式为_____。