题目内容
【题目】某废水中含有Cr2O72-,为了处理有毒的Cr2O72-,需要先测定其浓度:取20mL 废水,加入适量稀硫酸,再加入过量的V1mL c1mol/L(NH4)2Fe(SO4)2溶液,充分反应(还原产物为Cr3+)。用c2mol/L KMnO4溶液滴定过量的Fe2+至终点,消耗溶液V2mL。则原废水中c(Cr2O72-)为(用代数式表示)
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
【答案】A
【解析】根据得失电子守恒,5Fe2+~ KMnO4,与高锰酸钾反应的亚铁离子的物质的量为V2mL×10-3L/mL×c2mol/L×5= 5V2 c2×10-3mol,因此与Cr2O72-反应的亚铁离子为V1mL×10-3L/mL× c1mol/L-5V2 c2×10-3mol=(V1 c1×10-3 -5V2 c2×10-3)mol,根据得失电子守恒,有6Fe2+~Cr2O72-,则n(Cr2O72-)=![]() (V1 c1×10-3 -5V2 c2×10-3)mol,c(Cr2O72-)=
(V1 c1×10-3 -5V2 c2×10-3)mol,c(Cr2O72-)=![]() =
=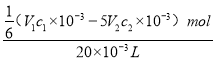 =
=![]() mol/L,故选A。
mol/L,故选A。

 综合自测系列答案
综合自测系列答案【题目】Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Ⅰ:下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入__________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
II:制备高铁酸钾的方法有干法和湿法。
(3)干法制备高铁酸钾的主要反应为:
2FeSO4+ 6Na2O2= 2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的还原剂是_______,每生成lmolNa2FeO4转移____个电子。
②简要说明K2FeO4作为水处理剂时所起的作用________________________________,
(4)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____________________________________。


