题目内容
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
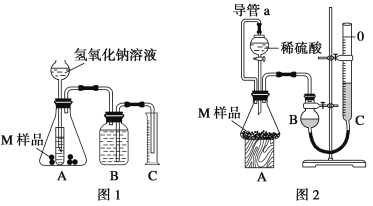
(1)写出实验1中可能发生反应的离子方程式:______________________________。
(2)实验1装置中小试管的作用是___________________________________________________。
(3)对于实验2,平视读数前应依次进行的两种操作是:①___________________②___________________。
(4)M样品中铜的质量的数学表达式为(用V1和V2 表示):__________________________。
(5)实验1进行实验前,B瓶中水没有装满,使测得气体体积____________ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________。
(6)该实验需要0.50 mol·L-1的NaOH溶液470 mL,请回答下列问题:
①配制时应称量______g NaOH,称量时需要托盘天平、______、______ (填仪器名称)。
②配制配制NaOH溶液时,将NaOH固体在烧杯中溶解,所得溶液立即转移至容量瓶中____(填“偏大”、“偏小”或“无影响”)。
③配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(7)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是____mol·L-1。
【答案】2Al+2OH-+2H2O===2AlO2-+3H2↑ 液封,避免氢气从长颈漏斗中逸出 控制加氢氧化钠溶液的体积来控制反应的快慢 节省药品 冷却到室温②调整BC液面相平 m(Cu)=![]() =
=![]() 无影响 偏大 10.0 小烧杯(或称量瓶)、药匙 偏大 偏大 18.4 mol/L
无影响 偏大 10.0 小烧杯(或称量瓶)、药匙 偏大 偏大 18.4 mol/L
【解析】
据题意,M只含铁、铝、铜三种金属中的两种或三种,其中铝既能与强酸反应,又能与强碱反应;铁只能溶于强酸,不溶于强碱;铜既不溶于氢氧化钠,也不溶于稀硫酸,据此分析。
据题意,M只含铁、铝、铜三种金属中的两种或三种,其中铝既能与强酸反应,又能与强碱反应;铁只能溶于强酸,不溶于强碱;铜既不溶于氢氧化钠,也不溶于稀硫酸。
(1)M样品(只含Fe、Al、Cu),只有铝与氢氧化钠溶液能反应,则实验1中可能发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)实验1的装置中,小试管的作用是对长颈漏斗起到液封作用,防止氢气逸出,控制加液体量,调节化学反应速率,节省药品;
故答案为:液封,避免氢气从长颈漏斗中逸出,控制加氢氧化钠溶液的体积来控制反应的快慢,节省药品;
(3)对于实验2,平视读数前应等到冷却到室温,并上下移动C量气管,使B、C液面相平,其目的是使B管收集的气体压强等于外界大气压,这样读得的读数才准确,
故答案为:冷却到室温;调整BC液面相平;
(4)根据V1结合铝与氢氧化钠的反应可知样品中铝的质量为![]() ,铁和铝都与酸反应生成氢气,所以根据V2-V1即为铁与盐酸反应生成的氢气,所以样品中铁的质量为
,铁和铝都与酸反应生成氢气,所以根据V2-V1即为铁与盐酸反应生成的氢气,所以样品中铁的质量为![]() ,所以样品中铜的含量为m(Cu)=
,所以样品中铜的含量为m(Cu)=![]() =
=![]() ;
;
(5)如果实验前B瓶液体没有装满水,不影响实验结果,因为理论上B管收集的气体体积等于排入C管里液体的体积;若拆去导管a,加入液体时,排出锥形瓶中部分空气,导致测定的气体体积偏大;
(6)①要配制0.50molL-1的NaOH溶液470mL,所用容量瓶应为500mL,所以配制时应称量0.50molL-1×0.5L×40g/mol=10.0g NaOH,称量时氢氧化钠要放在小烧杯(或称量瓶)中进行,用药匙取药品;
②NaOH固体中含有Na2O杂质,氧化钠与水反应生成氢氧化钠,使得溶液中氢氧化钠偏多,所以会导致所配溶液浓度偏大;
(7)根据c=![]() 可得浓硫酸的物质的量浓度为
可得浓硫酸的物质的量浓度为![]() mol/L=18.4mol/L。
mol/L=18.4mol/L。

【题目】对牙膏中物质的探究要用到许多化学知识。
(1)下表列出了三种牙膏中的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:
牙膏 | 两面针牙膏 | 佳洁士牙膏 | 中华牙膏 |
摩擦剂 | 氧化镁(MgO) | 碳酸钙(CaCO3) | 二氧化硅 (SiO2) |
摩擦剂的物质类别(指酸、碱、盐、酸性氧化物、碱性氧化物) | _________ | _________ | _________ |
(2)根据推测,牙膏摩擦剂的溶解性是_________(填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。某学生设计了一种实验室制备碳酸钙的实验方案,其流程图如下:
石灰石![]() 生石灰
生石灰![]() 石灰水
石灰水![]() 碳酸钙
碳酸钙
请写出上述方案中有关反应的化学方程式:
①___________________ ③___________________。

