题目内容
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
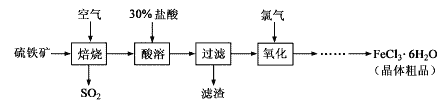
(1)氧化过程中发生反应的离子方程式是__________________,检验氧化生成的阳离子的试剂是________________。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。

①装置c的作用是____________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理__________,请说明理由__________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①SO2含量的表达式是_____________(用含m、V的代数式表示)。
②从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
【答案】 2Fe2++Cl2===2Cl-+2Fe3+ KSCN溶液 防止空气中的水蒸气、CO2被B装置吸收 否 尾气中的CO2也能被B装置吸收使所测质量分数偏大 ![]() % 蒸发浓缩 Fe3++3H2O
% 蒸发浓缩 Fe3++3H2O![]() Fe(OH)3+3H+,过量盐酸能够抑制Fe3+水解
Fe(OH)3+3H+,过量盐酸能够抑制Fe3+水解
【解析】黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,据此解答。
(1)黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氧化过程中发生反应的离子方程式是2Fe2++Cl2=2Cl-+2Fe3+,检验铁离子可以使用硫氰化钾溶液,现象是显示红色;(2)方案一:二氧化硫属于酸性气体,能被碱石灰吸收,B中碱石灰增重的质量即为二氧化硫的质量,则①碱石灰增重的质量即为二氧化硫的质量,但是碱石灰还能吸收空气中的二氧化碳和水,所以C中的碱石灰是吸收空气中的水以及二氧化碳的,防止进入B中干扰试验结果;②尾气中主要含N2、O2、SO2和少量的CO2、H2O,其中的水被浓硫酸吸收,但是碱石灰吸收的是二氧化碳和二氧化硫的总质量,测得的体积分数会偏大,所以不能根据碱石灰增重来确定二氧化硫的体积分数;方案二:二氧化硫可以和溴水之间反应得到硫酸,硫酸和氯化钡之间反应生成硫酸钡沉淀,根据沉淀的质量结合S元素守恒可以得到二氧化硫的量,进而计算体积分数;①硫酸钡沉淀的质量是mg,所以硫元素的物质的量=m/233mol=二氧化硫的物质的量,所以VL尾气中SO2的体积分数是:![]() ;②氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,由于铁离子水解:Fe3++3H2O
;②氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体,由于铁离子水解:Fe3++3H2O![]() Fe(OH)3+3H+,因此必须在盐酸环境中进行,防止铁离子水解,保证盐酸过量。
Fe(OH)3+3H+,因此必须在盐酸环境中进行,防止铁离子水解,保证盐酸过量。