��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ����ȡ��̽���������ʣ�������װ��(���ּг�װ������ȥ)����ʵ�顣[��ȡ�����ķ�Ӧԭ����2NH4Cl+Ca(OH)2=CaCl2+2NH3��+2H2O]

��ʵ��̽����
(1)��������ԭ����ʵ������ȡ����Ӧѡ����ͼ�� ����װ�ý���ʵ�顣
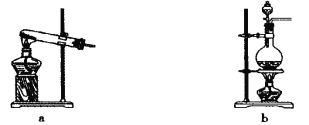
(2)Bװ���еĸ������ѡ�� (���ʯ�ҡ���Ũ���ᡱ)��
(3)��5.35 g NH4Cl����������Ca(OH)2��Ӧ�������Ƶñ�״���°��������Ϊ L��(NH4Cl��Ħ������Ϊ53.5 g��mol��1)
(4)����ͨ��C��Dװ��ʱ����ֽ��ɫ�ᷢ���仯���� (�C����D��)��
(5)��ʵ�����һ��ʱ���ѹEװ���еĽ�ͷ�ιܣ�����1��2��Ũ���ᣬ�ɹ۲쵽�������� ��
(6)Fװ���е���©�������� ��
����չӦ�á�
(7)ijͬѧ�ð����͵μӷ�̪��ˮ����Ȫʵ�飬������ƿ�ڲ�����ɫ��Ȫ������˵���������� ����(�����)��
a����ԭ�� b����������ˮ c����ˮ��Ӧ���ɼ�������
(8)��������;�ܹ㡣����ð����������������� 8NH3 + 6NO2 =7N2 + 12H2O
�÷�Ӧ�а������� (������ԡ���ԭ�ԡ�)��
�����оٳ���������һ����; ��
���𰸡�(12��)
��1��a(1��)
��2����ʯ��(1��)
��3��2.24(2��)
��4��D(1��)
��5����������(1��)
��6����ֹ����(1��)
��7��bc(˵������ֻѡb��ֻѡc��1�֣�����ֻҪ����a������)����(2��)
��8����ԭ��(2��)��������ڵ���(��)��ԭ�Ϣ������ԭ�Ϣܻ���ԭ��
��������ѡ��һ��������������Ҳ���֣�(1��)
��������
���������
��1����������ԭ����Ϊ��������ͣ���ѡ��aװ�á�
��2������Ϊ�������壬�����ü�ʯ�Ҹ��
��3��5.35 g NH4Cl�������ʵ���Ϊ0.1mol�����ݷ�Ӧ����ʽ�������Եõ�0.1mol��������״���°��������Ϊ2.24L��
��4��������ˮ��Ӧ���ɵ�һˮ�ϰ�����ʼ��ԣ�ʹ��ɫʯ����ֽ������������ͨ��C��Dװ��ʱ����ֽ��ɫ�ᷢ���仯����ʪ��ĺ�ɫʯ����ֽ����D��
��5��Ũ�����백����Ӧ�����Ȼ�粒��壬�ɹ۲쵽��������������
��6��Fװ���е���©���������Ƿ�ֹ������
��7�������͵μӷ�̪��ˮ������ɫ��Ȫ��˵��������������ˮ������ˮ��Ӧ���ɼ���������
��8��NH3ת��ΪN2����̬���ߣ����ְ�����ԭ�ԡ��������ж�����;������������ڵ���(��)��ԭ�Ϣ������ԭ�Ϣܻ���ԭ����




