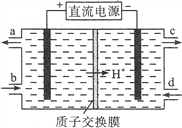
题目内容
【题目】治理汽车尾气的方法之一是在汽车排气管上装一个“催化转换器”。发生的化学反应为:2CO+2NO = N2+2CO2 ,其中的氧化剂是
A. NO B.CO C.N2 D.CO2
【答案】A
【解析】
试题分析:化学2CO+2NO=N2+2CO2中,NO中氮元素的化合价降低,被还原,具有氧化性,为氧化剂;CO中碳元素的化合价升高,具有还原性,被氧化,生成物中N2为还原产物,CO2为氧化产物。故选A。

【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:

已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。