题目内容
【题目】【2016年北京Ⅰ卷】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ: 。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是 。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是 。
b.证实沉淀中含有Cu2+和SO32的理由是 _。
(3)已知:Al2(SO4)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和 。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二: (按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有 。盐溶液间反应的多样性与 有关。
【答案】 (1)2Ag++SO![]() ===Ag2SO3↓(2)①析出红色固体 ②a.HCl和BaCl2溶液 b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO
===Ag2SO3↓(2)①析出红色固体 ②a.HCl和BaCl2溶液 b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO![]() 转化为SO
转化为SO![]() (3)①Al3+、OH-
(3)①Al3+、OH-
②a.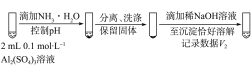 b.V1明显大于V2(4)亚硫酸盐的溶解性、氧化还原性、在水溶液中的酸碱性 两种盐溶液中阴、阳离子的性质和反应条件
b.V1明显大于V2(4)亚硫酸盐的溶解性、氧化还原性、在水溶液中的酸碱性 两种盐溶液中阴、阳离子的性质和反应条件
【解析】(1)实验Ⅰ中0.2 mol·L-1Na2SO3溶液与饱和Ag2SO4溶液发生反应生成白色沉淀Ag2SO3。离子方程式为2Ag++SO![]() ===Ag2SO3↓。(2)①根据反应:Cu+
===Ag2SO3↓。(2)①根据反应:Cu+![]() Cu+Cu2+知,若沉淀中含有Cu+,加入稀硫酸会发生歧化反应生成铜单质,实验现象是有红色固体生成;②分析实验流程知实验原理为2Cu2++4I-===2CuI↓+I2、I2+SO
Cu+Cu2+知,若沉淀中含有Cu+,加入稀硫酸会发生歧化反应生成铜单质,实验现象是有红色固体生成;②分析实验流程知实验原理为2Cu2++4I-===2CuI↓+I2、I2+SO![]() +H2O===SO
+H2O===SO![]() +2I-+2H+,SO
+2I-+2H+,SO![]() +Ba2+===BaSO4↓。a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液。b.证明沉淀中含有Cu2+和SO
+Ba2+===BaSO4↓。a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液。b.证明沉淀中含有Cu2+和SO![]() 的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO
的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO![]() 。(3)①实验Ⅲ的白色沉淀中无SO
。(3)①实验Ⅲ的白色沉淀中无SO![]() ,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色,推测沉淀中含有亚硫酸根和Al3+、OH-。②欲证明沉淀中亚硫酸根存在于铝的碱式盐中,步骤一中引入了SO
,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色,推测沉淀中含有亚硫酸根和Al3+、OH-。②欲证明沉淀中亚硫酸根存在于铝的碱式盐中,步骤一中引入了SO![]() ,提供了铝的碱式盐环境,作为对照实验,步骤二中应加入NH3·H2O。
,提供了铝的碱式盐环境,作为对照实验,步骤二中应加入NH3·H2O。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案