题目内容
1.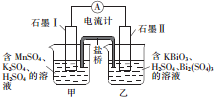 已知KBiO2+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池(盐桥中装有含琼胶的饱和K2SO4溶液),下列说法正确的是( )
已知KBiO2+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池(盐桥中装有含琼胶的饱和K2SO4溶液),下列说法正确的是( )| A. | 电池工作时,电子移向为石墨Ⅰ→溶液→盐桥→溶液→石墨Ⅱ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 甲烧杯中发生的电极反应为Mn2+-4e-+4H2O═MnO4-+8H+ | |
| D. | 电池工作一段时间后乙烧杯中溶液的pH增大 |
分析 根据反应KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4中,KBiO3→Bi2(SO4)3,Bi元素化合价降低被还原,MnSO4→KMnO4,Mn元素化合价升高被氧化,则该原电池中负极甲石墨Ⅰ变化为:MnSO4→KMnO4,电极反应为Mn2+-5e-+4H2O═MnO4-+8H+,正极乙石墨Ⅱ变化为:KBiO3→Bi2(SO4)3,电极反应为BiO3-+2e-+6H+═Bi3++3H2O,据此分析.
解答 解:反应KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4中,KBiO3→Bi2(SO4)3,Bi元素化合价降低被还原,MnSO4→KMnO4,Mn元素化合价升高被氧化,则该原电池中负极甲石墨Ⅰ变化为:MnSO4→KMnO4,电极反应为Mn2+-5e-+4H2O═MnO4-+8H+,正极乙石墨Ⅱ变化为:KBiO3→Bi2(SO4)3,电极反应为BiO3-+2e-+6H+═Bi3++3H2O,
A、电池工作时,电子移向为负极移向正极,但不经过溶液,故A错误;
B、盐桥中钾离子带正电荷,其移动方向为移向正极,则钾离子移向乙烧杯,故B错误;
C、负极甲石墨Ⅰ变化为:MnSO4→KMnO4,电极反应为Mn2+-5e-+4H2O═MnO4-+8H+,故C错误;
D、正极乙石墨Ⅱ变化为:KBiO3→Bi2(SO4)3,电极反应为BiO3-+2e-+6H+═Bi3++3H2O,消耗氢离子,则pH增大,故D正确;
故选:D.
点评 本题考查原电池的工作原理及常见的化学电源,明确氧化还原反应中元素的化合价变化及原电池工作原理是解答本题的关键,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
11.下列物质的沸点按由高到低的顺序排列正确的是( )
①CH3(CH2)2CH3 ②(CH3)3CH ③CH3(CH2)3CH3 ④(CH3)2CHCH2CH3.
①CH3(CH2)2CH3 ②(CH3)3CH ③CH3(CH2)3CH3 ④(CH3)2CHCH2CH3.
| A. | ②④①③ | B. | ④②①③ | C. | ④③②① | D. | ③④①② |
12.下列各组物质的晶体中化学键类型相同,晶体类型也相同的是( )
| A. | CO2和H2O | B. | NaCl和HCl | C. | SO2和SiO2 | D. | NaOH和CCl4 |
9.下列化学用语不正确的是( )
| A. | H2O2的电子式: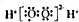 | B. | 硫离子的结构示意图为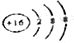 | ||
| C. | 二氧化碳的结构式:O=C=O | D. | CH4分子的比例模型: |
16.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |
10.下列说法不正确的是( )
| A. | 对稀土元素及化合物的研究是获得优良催化剂的一种重要途径 | |
| B. | 油脂是人体中热值最高的营养物质,在工业上可用于制肥皂和油漆 | |
| C. | 离子键、共价键和氢键等化学键都可能对物质的熔沸点产生影响 | |
| D. | 高分子膜在分离提纯、物质制备以及能量转化等领域都有广泛应用 |
11.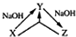 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |
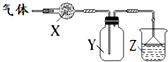 如图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是( )
如图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是( )
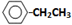 .
.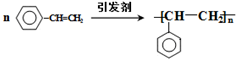 .
.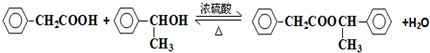 .
.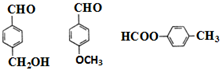 (其中两种).
(其中两种).