题目内容
氮化钠(Na3N)是一种实施管制的化学品,它是科学家制备的一种重要的化合物,与水作用可产生NH3。
请回答下列问题:
(1)Na3N的电子式是____________,该化合物是由________键形成的。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种微粒的半径:
r(Na+)________r(N3-)(填“>”“=”或“<”)。
(1)Na+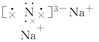 离子
离子
(2)2 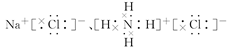
(3)复分解 (4)<
解析

练习册系列答案
相关题目
CS2和S2Cl2都是硫的重要化合物,在工业上有广泛的用途。二者的部分性质如下:
| | 熔点/℃ | 沸点/℃ | 密度/g·cm—3[来源 | 水 |
| CS2 | —110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | —76 | 138 | 1.75 | 水解 |
(1)①在 CS2+3Cl2=CCl4(g)+S2Cl2反应中,化合价没发生变化的元素是 。
②在CS2和S2Cl2中,含有非极性键的是 。
(2)以CS2或单质硫做原料与氯气反应都可以制得S2Cl2。下图是实验室里通过在熔融的单质硫中通入少量氯气的方法制取S2Cl2的装置(夹持装置、加热装置均已略去)。
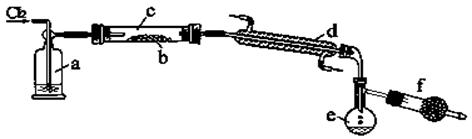
①装置a中的试剂是 ,其作用是 ;
装置d的名称是 ,其作用是 。
②该实验的操作顺序应是 (用序号表示)。
A.加热装置c B.通入Cl2 C.通冷凝水 D.停止通入Cl2
E.停止加热装置c
③f装置中的试剂是 ,其作用是 。
 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是


 B. 金刚石、
B. 金刚石、
