题目内容
下列各组中,含的离子晶体、分子晶体、原子晶体各一种的是( )
A.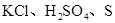 B. 金刚石、
B. 金刚石、
C. HF、SiC、Ar D. 
D
解析试题分析:A.KCl是离子晶体,而H2SO4、S单质都是分子晶体。错误。B. 金刚石是原子晶体;Na3PO4是离子晶体,Mg是金属晶体。错误。C. HF、Ar都是分子晶体,而 SiC是原子晶体。错误。D. H2O是分子晶体;SiO2是原子晶体;K2CO3是离子晶体.符合题意。正确。
考点:考查晶体的类型及判断的知识。

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
下列数据是对应物质的熔点: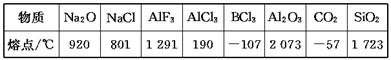
据此做出的下列判断中错误的是( )
| A.铝的化合物的晶体中有的是离子晶体 |
| B.表中只有BCl3和干冰是分子晶体 |
| C.同族元素的氧化物可形成不同类型的晶体 |
| D.不同族元素的氧化物可形成相同类型的晶体 |
最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为 ( )
| A.Ti14C13 | B.TiC | C.Ti4C4 | D.Ti4C3 |
据美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800 K,制得具有高熔点、高硬度的二氧化碳晶体。下列关于该晶体的说法正确的是( )
| A.该晶体属于分子晶体 |
| B.该晶体易汽化,可用作制冷材料 |
| C.一定条件下,该晶体可跟氢氧化钠反应 |
| D.每摩尔该晶体中含5 mol C—O键 |
某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶角和面心,则该晶体的化学式为( )。
| A.B2A | B.BA2 | C.B7A4 | D.B4A7 |
下列对化学知识概括合理的是( )。
| A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键 |
| B.同素异形体之间的转化都是物理变化 |
| C.原子晶体的熔点不一定比金属晶体的高,分子晶体的熔点不一定比金属晶体的低 |
| D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
下列叙述不正确的是( )
| A.金刚石、碳化硅、晶体硅的熔点依次降低 |
| B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2- |
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为 · · cm cm |
| D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3 |