题目内容
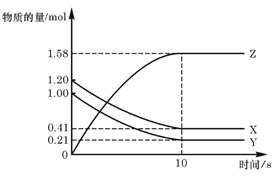
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)若达到平衡的标志是( )
2C(气)若达到平衡的标志是( )
A. C的生成速率与B的生成速率相等B. 混合气体的平均相对分子质量不变
C. 单位时间内生成nmolA,同时生成3nmolBD. A、B、C的分子数之比为1:3:2
【答案】B
【解析】
达到平衡状态时正、逆反应速率相等,正、逆反应速率相等是指用同一种物质来表示的反应速率,不同物质表示的反应速率与化学计量数成正比。
A项、C的生成速率与B的生成速率之比为3:2时,说明正逆反应速率相等,反应达到平衡状态,故A错误;
B项、该反应是一个体积体积减小的反应,由质量守恒定律可知,平衡前后气体质量不变,反应中容器内气体的平均摩尔质量增大,则容器内气体的平均摩尔质量不变,能表明反应已达到平衡状态,故B正确;
C项、单位时间内生成nmolA和生成3nmolB均为正反应速率,不能说明正逆反应速率相等,无法判断是否达到平衡状态,故C错误;
D项、A、B、C三种物质的分子数之比是1:3:2,没有说明保持1:3:2不变,无法判断是否达到平衡状态,故D错误;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表列出了A~R 10种元素在周期表中的位置(填元素符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | J | F | |||||
3 | A | C | D | G | R | |||
4 | B | H |
i. 请填空:
(1)这10种元素中,化学性质最不活泼的是____(填元素符号)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是____。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为____(填元素符号)。
(4)EF2的电子式为____,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是____。
(5)G元素和H元素两者核电荷数之差是____。
ii. 元素J的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
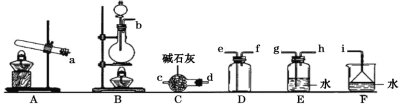
①只用固体药品制备氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)。
③将上述收集到的NH3充入无色透明烧瓶中,并加入少量催化剂,然后充入NO2。常温下反应一段时间后的实验现象为____,反应的化学方程式为____。