题目内容
【题目】已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
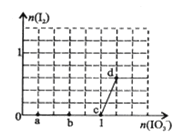
A. a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B. b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C. c点到d点的反应中共转移0.6mol电子
D. 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5 HSO3- + 2IO3- == I2+ 5SO42-+ 3H++ H2O
【答案】D
【解析】
还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2。
因为还原性HSO-3>I-,所以首先是发生以下离子反应:IO3-+3HSO3-═I-+3SO42-+3H+,此时碘元素被还原,A错误;b点是酸性溶液,反应的离子方程式为:IO3-+3HSO3-═I-+3SO42-+3H+,B错误;c点时加入的KIO3物质的量为1mol,和3molNaHSO3的溶液恰好完全反应,即2IO3-+6HSO3-═2I-+6SO42-+6H+,c点到d点,IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2,在d点时,KIO3与NaHSO3反应恰好生成0.6I2,共转移5×0.6=0.3mol电子,C错误;向200mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,HSO3-被氧化为SO42-,KIO3过量,由于氧化性IO-3>I2,KIO3将氧化为I-,反应不能生成I-,而是生成I2,反应离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O,D正确。
故选D。

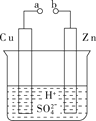
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
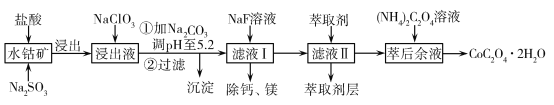
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO不会氧化Co2+,ClO转化为Cl-;③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2 HC2O4-
H++HC2O4- Ka1=5.4×10-2 HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH________7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水
C.饱和的(NH4)2C2O4溶液 D.稀盐酸
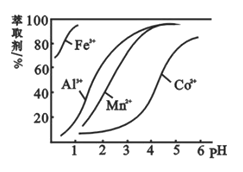
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5