题目内容
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
| A.加入适量的氢氧化钠固体 | B.将溶液稀释到原体积的 10倍 |
| C.加入等体积0.2 mol·L-1氨水 | D.降低溶液的温度 |
A
解析试题分析:A.加入适量的氢氧化钠固体,可以使溶液中c(OH-)增大,可能使溶液的pH由a→(a+1).正确。B.将溶液稀释到原体积的10倍,溶液的pH减小,不可能变为(a+1)。错误。C.加入等体积0.2 mol·L-1氨水,氨水的浓度为(0.1+0.2)mol/L÷2=0.15mol/L.氨水浓度增大,溶液的pH增大,但是也不可能增大1个单位。错误。D.氨水中的一水合氨是弱电解质。降低温度,电离程度减小,电解质电离的程度越小,溶液中的c(OH-)越小,pH就越小。错误。
考点:考查影响弱电解质电离平衡的因素的知识。

100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
| A.pH=11的氨水中:c(OH-)=3.0mol·L-1 |
| B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-) |
| C.pH=2的稀盐酸中,c(H+)=c(Cl-) |
| D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) |
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 
| A.两条曲线间任意点均有c(H+)·c(OH-)=Kw |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。
下列说法错误的是
| A.沉淀中只有Fe(OH)3 | B.沉淀中有Fe(OH)3和Fe(OH)2 |
| C.滤液c(Fe3+)=4.0×10-8mol/L | D.向滤液中滴加FeCl2溶液,无沉淀产生 |
有0.1 mol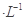 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,C(CH3COO-)=C(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+) |
| D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-) |
25℃时,已知弱酸的电离常数:K(CH3COOH) =" 1.8" ×10-5;K1(H2CO3) =" 4.4" ×10-7;K2(H2CO3) =" 4.7" × 10-11;K(HClO) =" 4.0" ×10-8。则下列说法正确的是
| A.新制氯水与碳酸氢钠不反应 |
| B.25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C.NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+ H2O = Na2CO3 +2HClO |
| D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO— + H+ K1=1.75×10-5 △H1>0
CH3COO— + H+ K1=1.75×10-5 △H1>0
CH3COO— + H2O CH3COOH + OH— K2=5.71×10-10 △H2>0
CH3COOH + OH— K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
| A.对混合溶液进行微热,K1增大、K2减小 |
| B.混合溶液的pH<7 |
| C.混合溶液中c(CH3COO—)>c(Na+) |
| D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小 |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
| A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
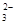 )+c(HCO
)+c(HCO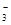 )]
)]