题目内容
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。
下列说法错误的是
| A.沉淀中只有Fe(OH)3 | B.沉淀中有Fe(OH)3和Fe(OH)2 |
| C.滤液c(Fe3+)=4.0×10-8mol/L | D.向滤液中滴加FeCl2溶液,无沉淀产生 |
B
解析试题分析:pH=4,则c(OH?)=10-10mol?L?1,带入Ksp公式可求得Fe3+浓度,c(Fe3+)=4.0×10-8 mol?L?1, e3+全部转化为Fe(OH)3沉淀,假设也能生成Fe(OH)2沉淀,达到沉淀溶解平衡时,c(Fe2+)=8.0×104mol?L?1,实际Fe2+浓度小于8.0×104mol?L?1,所以沉淀中没有Fe(OH)2,只有Fe(OH)3,故B项错误。
考点:本题考查沉淀溶解平衡、Ksp应用。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
下列比较中,正确的是( )
| A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后: c(NH  )>c(Cl )>c(Cl )>c(Na )>c(Na )>c(OH )>c(OH )>c(H )>c(H ) ) |
| C.物质的量浓度相等的H2S和NaHS混合溶液中: c(Na  )+ c(H )+ c(H )=c(S )=c(S )+ c(HS )+ c(HS )+ c(OH )+ c(OH ) ) |
D.同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
| A.加入适量的氢氧化钠固体 | B.将溶液稀释到原体积的 10倍 |
| C.加入等体积0.2 mol·L-1氨水 | D.降低溶液的温度 |
一定温度下,将0.1molAgCl加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是
A.沉淀转化反应2AgCl(s)+ CO32-(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1 Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1 |
| B.约有2×10-5mol AgCl溶解 |
| C.反应后溶液中的:c(Na+)>c (Cl-) >c (CO32-) >c (OH-) >c (H+) |
| D.反应后溶液中的:c(Na+)+ c (H+)+ c (Ag+)="2" c (CO32-)+ c (HCO3-)+ c (Cl-)+ c (OH-) |
现有常温下的五种溶液(如下表)。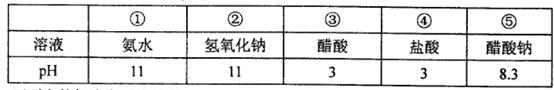
下列有关叙述中正确的是
| A.五种溶液中,水电离出的c(OH-)最小的是⑤ |
| B.将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)> c(OH-)。 |
| C.分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④ |
| D.在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(CH3COO-)> c(Cl-)>c(OH-)= c(H+)。 |
常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量( )
| A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L |
| D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )