题目内容
【题目】工业废催化剂中含有多种金属元素,某废催化剂主要含有SiO2、ZnO、ZnS和CuS,为充分利用资源,变废为宝,在实验室中探究回收废催化剂中的锌和铜,具体流程如图所示,回答下列问题:

已知:ZnS与稀硫酸反应且化合价不变;CuS既不溶于稀硫酸也不与稀硫酸反应。
(1)下列玻璃仪器或装置中,第一次浸出时尾气净化需要使用的装置为___________(填标号),“浓缩结晶”需要使用的仪器是_______________(填名称)。

(2)滤渣1的主要成分是 ___________。
(3)第二次浸出时,向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液。反应器中有淡黄色沉淀生成,写出反应的离子方程式___________;若顺序相反,会造成___________。
(4)第二次浸出时需要加热且控温,采用的合适加热方式是___________。
(5)某同学在实验完成之后,得到23.3g提纯的硫酸锌晶体(ZnSO4·xH2O)。为确定晶体化学式,取5.0g晶体,用蒸馏水完全溶解.再加入足量的氯化钡溶液,充分反应后过滤、___________、___________、称重得固体4.1g,则硫酸锌晶体的化学式为___________。
【答案】D 蒸发皿 CuS、SiO2 CuS+H2O2+2H+=Cu2++S+2H2O H2O2与固体颗粒接触分解 热水浴 洗涤 干燥 ZnSO4.7H2O
【解析】
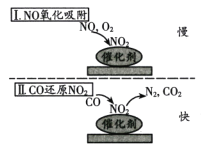
根据题给流程,第一次浸出为ZnO和ZnS与稀硫酸的反应,反应方程式为ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑,反应产生有毒气体,需要回收,滤渣1为CuS和SiO2的混合物;第二次浸出时为CuS和稀硫酸、双氧水的反应,反应方程式为CuS+H2O2+H2SO4=CuSO4+S+2H2O,滤渣2为SiO2,据此分析。
(1)根据分析,第一次浸出时产生了有毒气体H2S,需要回收,根据4个装置,装置D可以将H2S回收处理,故选D;浓缩结晶时需要蒸发皿进行蒸发;
(2)根据分析,滤渣1的主要成分为CuS和SiO2;
(3)CuS在稀硫酸和过氧化氢同时存在下会发生反应产生硫单质,反应的离子方程式为CuS+H2O2+2H+=Cu2++S+2H2O;反应式若先加入过氧化氢,则CuS会作为催化剂使过氧化氢分解;
(4)第二次浸出时加入了过氧化氢,在高温时易分解,反应温度不宜过高,需要控制温度,在反应时可以使用热水浴进行控温;
(5)将得到的固体经过滤、洗涤、干燥后称量质量,得到4.1g硫酸钡,则含有硫酸根![]() =0.0176mol,故含有硫酸锌0.0176 mol,约为2.83 g,则含有水2.17 g,约为0.121 mol,ZnSO4与H2O的物质的量比约为1:7,所以硫酸锌晶体的化学式为ZnSO4·7H2O。
=0.0176mol,故含有硫酸锌0.0176 mol,约为2.83 g,则含有水2.17 g,约为0.121 mol,ZnSO4与H2O的物质的量比约为1:7,所以硫酸锌晶体的化学式为ZnSO4·7H2O。

【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:

(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。