题目内容
【题目】七种第三周期元素,其浓度均为0.01 mol·L-1的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
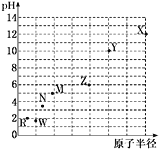
A.气态氢化物的稳定性:N>R
B.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
C.Z的最高价氧化物对应的水化物能溶于稀氨水
D.元素Y和R形成的化合物既含离子键又含共价键
【答案】B
【解析】
元素的金属性越强,其对应最高价氧化物的水化物碱性越强,则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,其中硫酸为二元强酸,高氯酸为一元强酸,则硫酸的pH小于高氯酸,所以X、Y、Z、M、N、R、W分别为Na、Mg、Al、Si、P、S、Cl元素。
A. 同周期元素,原子半径越大,非金属性越弱,所以气态氢化物的稳定性:N < R,故A错误;
B. 由分析可知X最高氧化物对应的水化物为NaOH,M最高价氧化物对应的水化物为SiO2,反应后生成Na2SiO3是强碱弱酸盐,溶液呈碱性,pH>7,故B正确;
C. Z的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝能溶于强碱但不能溶于弱碱,所以不能溶于稀氨水,故C错误;
D. 元素Y和R形成的化合物是MgCl2,是离子化合物,只含有离子键,故D错误;
正确答案是B。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目