题目内容
【题目】电解原理在化学工业中有着广泛的应用。现将设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y是两块电板板,则:

(1)若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是________________________。
(2)若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质的电解总反应方程式为:________________,将其露置在空气中可观察到的现象为______。
(3)若X和Y均为情性电板,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2,恰好恢复电解前的浓度,则电解过程中转移的电子的物质的量为______。
(4)某同学为了使反应2HCl+2Ag=2AgC1+H2↑能在上述装置中进行,则电解液及电极分别为:___________________。
【答案】 将湿润的淀粉碘化钾试纸靠近Y极支管口,试纸变蓝,说明有氯气生成 Fe+2H2O![]() Fe(OH)2+H2↑ 白色固体迅速变为灰绿色,最终变为红褐色 0.4mol Y电极为银,a为HC1溶液
Fe(OH)2+H2↑ 白色固体迅速变为灰绿色,最终变为红褐色 0.4mol Y电极为银,a为HC1溶液
【解析】(1)以惰性电极电解NaCl溶液时,阳极发生氧化反应,根据氯气的性质进行检验;
(2)阳极为铁电极时,是活泼电极,会失电子发生氧化反应,亚铁离子不稳定易被氧化;
(3)根据电解质复原的方法:出什么加什么,出多少加多少,结合电子守恒来计算;
(4)根据电解原理解答。
由电解池装置可知,Y为电解池阳极,X为电解池阴极。
(1)以惰性电极电解NaCl溶液时,阳极反应产物为Cl2,氯气具有强氧化性,可用湿润的淀粉碘化钾试纸检验,将湿润的淀粉碘化钾试纸靠近Y极支管口,试纸变蓝,说明有氯气生成;
(2)阳极为铁电极时,阳极反应为Fe-2e-=Fe2+,阴极氢离子放电,产生氢氧根离子,所以有氢氧化亚铁生成,总反应式为Fe+2H2O![]() Fe(OH)2+H2↑;氢氧化亚铁易被氧化,露置在空气中时迅速变为灰绿色,最终变为红褐色;
Fe(OH)2+H2↑;氢氧化亚铁易被氧化,露置在空气中时迅速变为灰绿色,最终变为红褐色;
(3)电解CuSO4溶液后补充CuO即可复原,而题中加入0.1 mol Cu(OH)2才能复原,说明CuSO4电解完毕后又有水被电解,加入0.1 mol Cu(OH)2相当于加0.1 mol CuO和0.1 mol H2O,即说明电解了0.1 mol CuSO4和0.1 mol H2O,故共转移0.4 mol电子;
(4)反应中银失去电子,氢离子得到电子,因此要使反应2HCl+2Ag=2AgC1+H2↑能在上述装置中进行,则阳极是银,即Y电极为银,电解液是盐酸,即a为HC1溶液。

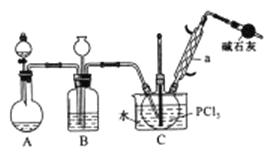
【题目】三氯氧磷(POCl2)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________。
(2)B装置的作用除观察O2的流速之外。还有__________________________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取xg 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol/L 的AgNO3容液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol/LNH4SCN 溶液滴定过量Ag+至终点,记下所用 体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是________________(填标号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____________________。
③步骤Ⅲ加入硝基苯的目的是_________________,如无此操作,所测Cl元素含量将会____________填“偏大”“ 偏小”或“不变”)。