题目内容
11.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,会引起滴定结果偏低的是( )| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定前平视滴定管刻度线,滴定终了俯视刻度线 | |
| D. | 滴定前酸式滴定管尖嘴部分有气泡,滴定终了无气泡 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A、用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定,标准液的浓度偏小,消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析c(待测)偏大,故A错误;
B、用蒸馏水洗涤锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定,待测液的物质的量偏大,消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析c(待测)偏大,故B错误;
C、滴定前读酸液体积时平视,滴定后读酸液体积时俯视,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析c(待测)偏小,故C正确;
D、滴定前酸式滴定管尖嘴部分有气泡,滴定终了无气泡,导致V(标准)偏大,据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析,c(待测)偏高,故D错误;
故选:C.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,根据课本知识即可完成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.已知常温下在溶液中可发生如下两个离子反应:
Ce 4++Fe 2+═Fe 3++Ce 3+
Sn 2++2Fe 3+═2Fe 2++Sn 4+
由此可以确定Fe 2+、Ce 3+、Sn 2+三种离子的还原性由强到弱的顺序是( )
Ce 4++Fe 2+═Fe 3++Ce 3+
Sn 2++2Fe 3+═2Fe 2++Sn 4+
由此可以确定Fe 2+、Ce 3+、Sn 2+三种离子的还原性由强到弱的顺序是( )
| A. | Sn 2+、Fe 2+、Ce 3+ | B. | Sn 2+、Ce 3+、Fe 2+ | ||
| C. | Ce 3+、Fe 2+、Sn 2+ | D. | Fe 2+、Sn 2+、Ce 3+ |
2.草酸作为一种很重要的化工原料,某一个学习小组的同学拟用甘蔗渣为原料用水解一氧化一水解的技术来制取草酸如图1
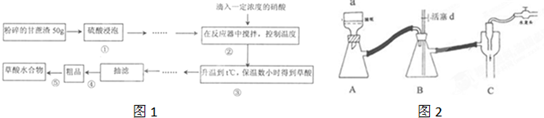
Ⅰ、步骤④是减压抽滤(如图2),其优点是:加快过滤速度、得到较干燥的沉淀,当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是慢慢打开活塞d,然后关闭水龙头.
Ⅱ、该小组同学为了确定产品H2C2O4•xH2O中的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol•L-1KMnO4溶液滴定. 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是$\frac{50W}{9c(b-a)}$-5
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大.为此,他们设计了实验进行探究:
【实验用品】:仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1mol/L H2C2O4溶液、0.1mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】:实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体.再在两支试管中各加入5滴0.1mol/LKMnO4溶液.现象如下(表1)
实验(2):在①号和②号试管中分别加入5m1 0.1mol/L H2C2O4溶液,在②号试管中再滴加l0滴稀硫酸,然后在两支试管中各加入5滴0.1mol/L 的高锰酸钾溶液.现象如下(表2)
实验(3):在①号、②号和③号试管中分别加入5m1 0.1mol/L H2C2O4溶液,然后在①、②、③号试管中依次加入10滴、l mL、2mL稀硫酸溶液,然后各加入5滴0.1mol/L的高锰酸钾溶液,然后置于温度为65℃的水浴中加热.观察现象如下(表3).
(1)设计实验(1)对应的假设是反应产物中的Mn2+可能是反应的催化剂.
实验(1)得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂],假设1成立.
(2)由实验(2)和实验(3)得出的结论是由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快,温度对该反应速率影响不大.

Ⅰ、步骤④是减压抽滤(如图2),其优点是:加快过滤速度、得到较干燥的沉淀,当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是慢慢打开活塞d,然后关闭水龙头.
Ⅱ、该小组同学为了确定产品H2C2O4•xH2O中的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol•L-1KMnO4溶液滴定. 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶.
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是$\frac{50W}{9c(b-a)}$-5
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大.为此,他们设计了实验进行探究:
【实验用品】:仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1mol/L H2C2O4溶液、0.1mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】:实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体.再在两支试管中各加入5滴0.1mol/LKMnO4溶液.现象如下(表1)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100s | 90s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88s | 100s | 120s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | ||
实验(1)得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂],假设1成立.
(2)由实验(2)和实验(3)得出的结论是由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快,温度对该反应速率影响不大.
16.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得得Fe(OH)3胶体中胶粒数为0.1NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将1mol氯气分别通入足量的FeBr2和FeI2溶液中转移电子数均为2NA | |
| D. | 等物质的量的NH4+和OH-含电子数均为10NA |
3.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )

| A. | 在(t1+10)min时,其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向右移动 | |
| C. | T℃时,在相同容器中,若由0.3 mol•L-1 A、0.1 mol•L-1 B和0.4 mol•L-1C反应,达到平衡后,C的浓度仍为0.4 mol•L-1 | |
| D. | 该反应为吸热反应,温度升高,平衡正向移动,A的转化率升高 |
20.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 甲 | 乙 | 丙 | |
| A | Na | H2O | Cl2 |
| B | Al | Fe2O3 | 稀H2SO4 |
| C | CH3CH2OH | NaOH溶液 | CH3COOH |
| D | Ba(OH)2溶液 | CO2 | Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.下列离子方程式正确的是( )
| A. | 向4 mL FeCl2溶液中滴加两滴浓硝酸:Fe2++2H++NO${\;}_{3}^{-}$═Fe3++NO2↑+H2O | |
| B. | 向石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| C. | 铝与稀硫酸反应:Al+2H+═Al3++H2↑ | |
| D. | 向NH4 Al(SO4)2加入少量的NaOH溶液:NH${\;}_{4}^{+}$+OH-═NH3.H2O |

 如图是三种类别的烃CnH m分子中碳原子数n(C原子)与含碳量C%的关系.
如图是三种类别的烃CnH m分子中碳原子数n(C原子)与含碳量C%的关系.