题目内容
2.在钢铁表面进行烤蓝(蓝色物质为Fe3O4,也可表示为FeFe2O4)的原理如下:①3Fe+NaNO2+5NaOH═3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O═Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O═Fe3O4+4NaOH
下列说法中不正确的是( )
| A. | 反应②配平后,H2O的化学计量数为5 | |
| B. | Fe3O4既可看作是氧化物,又可看作是亚铁盐 | |
| C. | 反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 | |
| D. | 碱性条件下,NaNO2的氧化性比Na2FeO2强 |
分析 A.配平后②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH;
B.含两种元素,且含氧元素,还可表示为FeFe2O4;
C.反应③中各元素的化合价不变;
D.氧化剂的氧化性大于氧化产物的氧化性.
解答 解:A.配平后②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH,则H2O的化学计量数为5,故A正确;
B.含两种元素,且含氧元素,还可表示为FeFe2O4,既可看作是氧化物,又可看作是亚铁盐,故B正确;
C.反应③中各元素的化合价不变,为非氧化还原反应,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,由此可判断碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强,故D正确.
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意习题中的信息及元素化合价判断,题目难度不大.

练习册系列答案
相关题目
10.某原子的原子结构示意图为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该原子位于第三周期,ⅤA族 | B. | 该原子位于第五周期,ⅢB族 | ||
| C. | 该原子位于第三周期,ⅤB族 | D. | 该原子位于第五周期,ⅢA族 |
11.称四份0.50g锌,按下列要求分别盛于四支试管里,塞上带导管的塞子,每隔一段时间分别测定生成氢气的体积.
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
①0.50g锌+5 mL 3 mol/L 硫酸;
②0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜片;
③0.50g锌+5 mL 3 mol/L 硫酸+0.1g铜粉;
④0.50g锌+5 mL 3 mol/L 硫酸+0.39g胆矾(相当于0.1g铜).
下列说法不正确的是( )
| A. | 生成氢气的速率从快到慢为④③②① | |
| B. | 四组实验反应完全后生成氢气的总量相等 | |
| C. | 四组实验反应完全后锌均无剩余 | |
| D. | 四组实验反应完全后所得的硫酸锌的物质的量相同 |
12.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性:HCl>HBr>HI | D. | 非金属性:F>O>S |
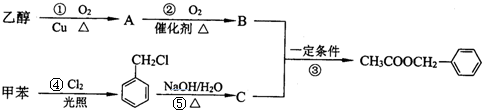
 .
.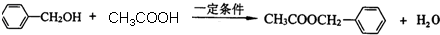 .
.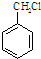 为原料经过三步反应合成
为原料经过三步反应合成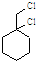 ,无机原料任选,写出反应的化学方程式:
,无机原料任选,写出反应的化学方程式: +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$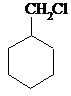
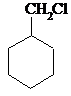 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$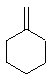 +NaCl+H2O
+NaCl+H2O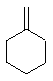 +Cl2→
+Cl2→ .
. 已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.
已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同. .
.