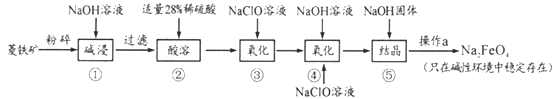
题目内容
【题目】A、B、C、D、E、F、G、H、I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:
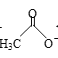
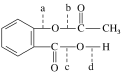
(1)B单质分子中![]() 与
与![]() 键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色的络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为______(写一种即可),该分子中心原子轨道的杂化类型为_______,该阴离子空间构型为_______。
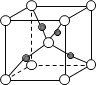
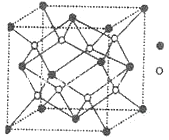
(3)D与G可以形成如图的晶胞,则黑点表示的是元素_______(填写元素符号),该元素原子在该晶胞中的配位数为______。
【答案】1:2 O<N<F 3d64s2 CO2(CS2、N2O) sp 直线形 Ca 8
【解析】
在前4周期中:因为A原子的最外层电子是次外层电子数的2倍,故A为C;由D为周期表中电负性最大的元素,D为F;故此,B为N,C为O;H为应用最广泛的金属,故H为Fe;I处于周期表中的第二副族,故I为Zn;又F与C位于同一主族,故F为S;因为E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,故E为Mg,G为Ca。
(1)由题干可知B为N,形成的单质是N2,含氮氮三键,故![]() 与
与![]() 键键数目比为1:2;氮原子中2p轨道是半满状态,能量较低,故N、O、F三者第一电离能由小到大的顺序为O<N<F;
键键数目比为1:2;氮原子中2p轨道是半满状态,能量较低,故N、O、F三者第一电离能由小到大的顺序为O<N<F;
(2)由题给条件可知H为Fe,故其价电子排布为:3d64s2;Fe3+遇SCN-生成血红色络合物,SCN-的等电子体有CO2、CS2、N2O等,类比CO2可知其中心原子杂化类型为sp杂化,故空间结构为直线形;
(3)因为D与G分别为F和Ca,分子式为CaF2,由所给晶胞示意图中黑点为4,白点为8,可知黑点为Ca,白点为F;又因为Ca在晶胞中是面心立方,故其配位数为8。

【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。