题目内容
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
Ⅰ![]() 铅蓄电池充放电的总反应为:
铅蓄电池充放电的总反应为:![]()
![]()
![]() ,锂硫电池充放电的总反应为:
,锂硫电池充放电的总反应为:![]()
![]()
![]() .
.
![]() 放电时,铅蓄电池的负极反应式为 ______ .
放电时,铅蓄电池的负极反应式为 ______ .
![]() 锂硫电池工作时,电子经外电路流向 ______
锂硫电池工作时,电子经外电路流向 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() .
.
![]() 当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
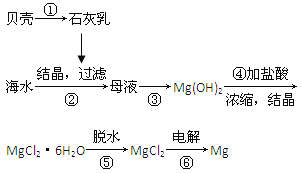
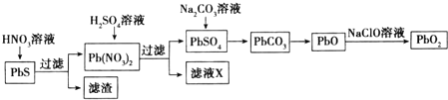
Ⅱ![]() 由方铅矿
由方铅矿![]() 制备铅蓄电池电极材料
制备铅蓄电池电极材料![]() 的方法如下:
的方法如下:
![]() 油画所用的白色颜料
油画所用的白色颜料![]() 置于空气中,遇
置于空气中,遇![]() 气体变成黑色PbS,从而使油画的色彩变暗,用
气体变成黑色PbS,从而使油画的色彩变暗,用![]() 清洗,可使油画“复原”.
清洗,可使油画“复原”.
![]() 的作用是 ______.
的作用是 ______.
![]() 已知硫化铅溶于水时存在溶解平衡:
已知硫化铅溶于水时存在溶解平衡:![]() ,试分析
,试分析![]() 能溶于稀
能溶于稀![]() 的原因 ______.
的原因 ______.
![]() 滤液X是一种可循环使用的物质,其溶质主要是 ____
滤液X是一种可循环使用的物质,其溶质主要是 ____ ![]() 填化学式
填化学式![]() ,若X中残留的
,若X中残留的![]() 过多,循环使用时可能出现的问题是 ____.
过多,循环使用时可能出现的问题是 ____.
![]() 与次氯酸钠溶液反应可制得
与次氯酸钠溶液反应可制得![]() ,写出该反应的离子方程式 ______ .
,写出该反应的离子方程式 ______ .
![]() 以石墨为电极,电解
以石墨为电极,电解![]() 溶液也可以制得
溶液也可以制得![]() ,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在
,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在![]() 溶液中加入适量
溶液中加入适量![]() ,理由是 ______ .
,理由是 ______ .
【答案】![]() 正极 14.8 氧化剂 硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解
正极 14.8 氧化剂 硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解 ![]() 浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率
浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率 ![]()
![]() 加入硝酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率
加入硝酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率
【解析】
Ⅰ.(1)放电时,铅蓄电池的负极发生氧化反应;
(2)原电池工作时电子由负极流向正极;
(3)铅蓄电池中207g铅消耗时转移 2mol e-,锂硫电池中7g锂消耗时转移1mol电子;
Ⅱ.PbS和硝酸发生氧化还原反应生成Pb(NO3)2和硫单质或硫酸,同时产生NOx,溶液中加入硫酸溶液,生成PbSO4沉淀和HNO3溶液,HNO3可以循环利用。PbSO4中加入碳酸钠溶液,PbSO4转化为PbCO3,PbCO3可以受热分解成PbO,PbO被NaClO氧化为PbO2。
Ⅰ(1)放电时,铅蓄电池的负极发生氧化反应,而铅离子与溶液中的硫酸根离子生成难溶的硫酸铅,电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)原电池工作时电子由负极流向正极,故答案为:正极;
(3)铅蓄电池中铅是负极,207g铅消耗时转移 2mol ![]() ,故锂硫电池的理论放电量是铅蓄电池的:
,故锂硫电池的理论放电量是铅蓄电池的:![]() 倍,故答案为:
倍,故答案为:![]() ;
;
Ⅱ(1)①过氧化氢将黑色PbS氧化成白色的硫酸铅,所以过氧化氢是氧化剂,故答案为:氧化剂;
②已知硫化铅溶于水时存在溶解平衡:![]() ,电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,故答案为:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
,电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,故答案为:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
(2)硝酸铅与硫酸发生复分解反应生成难溶硫酸铅和硝酸;残留的![]() 过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量,故答案为:
过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量,故答案为:![]() ;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;
;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;
(3)①![]() 和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为
和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为![]() ;故答案为:
;故答案为:![]() ;
;
![]() 电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为
电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为![]() ;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率,故答案为:
;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率,故答案为: ![]() ,加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率。
,加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率。

【题目】下列实验设计正确的是( )
操作 | 现象 | 结论 | |
A | 将SO2通入溴水 | 溴水褪色 | SO2具有漂白性 |
B | 将乙烯通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 乙烯具有还原性 |
C | 将澄清石灰水滴入某溶液 | 出现白色浑浊 | 其溶液中存在CO32- |
D | 将硝酸银溶液滴入某溶液 | 出现白色沉淀 | 其溶液中存在Cl- |
A.AB.BC.CD.D