题目内容
【题目】前四周期原子序数依次增大的六种元素A、B、D、X、Y、Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D﹣和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
(1)Z2+的价层电子排布式为 .
(2)D、X、Y三种元素中第一电离能从大到小的顺序是 . (填元素符号)
(3)分子式为AD的化合物常以多聚体(AD)n的形式存在,请解释原因 .
(4)B和氮原子可形成化合物(BN)2 , (BN)2分子中中心原子的杂化方式为 , φ键和π键的个数之比为 , 空间构型为 .
(5)D﹣、X+、Y3+三种离子组成的化合物X3YD6 , 其中化学键的类型有;该化合物中存在一个复杂离子,该离子的化学式为 , 配位体是 .
(6)Y晶体的晶胞如图所示,晶胞边长为apm,则Y的配位数为 , 晶体的密度为g/cm3 . (用NA 表示阿伏伽德罗常数的值)
【答案】
(1)3d8
(2)F>Fe>K
(3)HF分子间能形成氢键
(4)sp;3:4;直线形
(5)离子键和配位键;[FeF6]3﹣;F﹣
(6)8;![]()
【解析】解:和X的价电子层中未成对电子均只有1个,并且D﹣和X+的电子相差为8,而原子序数D>X,则D比X多两个电子层,由于都是前四周期元素,D至少位于第二周期,则X只能为第四周期元素,结合二者离子中所带电荷可知,D为F元素、X为K元素;A和B位于不同周期,B的原子序数小于D,则B位于第二周期、A处于第一周期,A的电子层数和最外层电子数相等,则A为H元素;非金属元素B的已成对电子数是未成对电子数的2倍,且处于第二周期,则B的电子排布式为:1s22s23p2 , 为C元素;Y、Z与X位于同一周期,说明Y和Z处于第四周期,二者的价电子层中的未成对电子数分别为4和2,且原子序数相差为2,则Y、Z的基态原子核外电子排布式分别为:1s22s22p63s23p63d64s2、1s22s22p63s23p63d84s2 , 即Y为Fe、Z为Ni,(1)Z为Ni元素,Z2+的核外电子排布式为:1s22s22p63s23p63d8 , 则其价层电子排布式为:3d8 , 所以答案是:3d8;(2)D,X,Y三种元素分别为F、K、Fe,金属性越强,第一电离能越小,非金属性越强,第一电离能越大,则三种元素中第一电离能从大到小的顺序是:F>Fe>K,
所以答案是:F>Fe>K;(3)A、D分别为H、F元素,F元素非极性较强,HF分子间能形成氢键,所以分子式为HF的化合物常以多聚体(HF)n的形式存在,
所以答案是:HF分子间能形成氢键;(4)B为C元素,C和氮原子可形成化合物(CN)2 , (CN)2分子中存在C≡N键,其结构式为:N≡C﹣C≡N,每个三键中含有2个π键和1个σ键,所以中心原子C原子的杂化方式为sp;(CN)2分子中含有3个σ键、4个π键,所以σ键和π键的数目之比为:3:4;其空间构型为直线形,所以答案是:sp;3:4;直线形;(5)A﹣、B+和C3+三种离子组成的化合物的K3FeF6 , 该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3﹣ , 配位体是F﹣ , 所以答案是:离子键和配位键;[FeF6]3﹣;F﹣;(6)Y为Fe元素,Fe位于晶胞体心,距离Fe最近的Fe原子位于晶胞顶点,共有8个,即Fe的配位数为8;该晶胞的边长为apm,则晶胞体积为(a×10﹣10cm)3 , 每个晶胞中含有Fe原子数为:8× ![]() +1=2,则晶胞的质量为:
+1=2,则晶胞的质量为: ![]() ×2g=
×2g= ![]() g,所以晶胞的密度为:
g,所以晶胞的密度为: 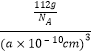 =
= ![]() g/cm3 , 所以答案是:8;
g/cm3 , 所以答案是:8; ![]() .
.

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的性,填写了如表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3﹣+2H+=Fe3++NO2↑+H2O |
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有;另一只试管滴加几滴溶液,产生蓝色沉淀,则含有Fe2+ .
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.
(4)该小组用如图装置进行探究: 
步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由与NO或NO2反应而的得到 |
② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的 |
③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想;不确定的是猜想 , 有待后续实验进一步探究.