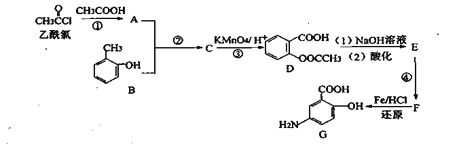
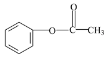
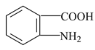
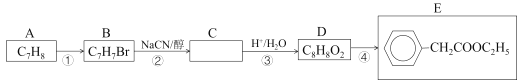
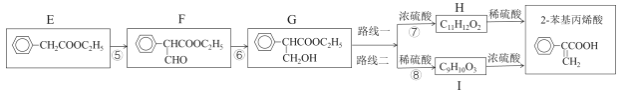
题目内容
【题目】工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
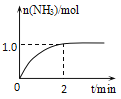
(1)0~2min内的平均反应速率v(H2)=___。
(2)该温度下,反应的平衡常数表达式K=___。
其平衡常数K与温度T的关系如下表:
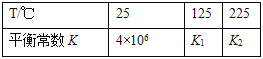
试判断K1___K2(填写“>”、“=”或“<”)。
(3)能说明该合成氨反应已达到平衡状态的是___(选填编号)。
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
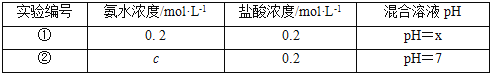
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
请回答:
(4)①中所得混合溶液,pH___7(填“>”、“<”或“=”);②中c__0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为___。
(5)请你设计一个能证明一水合氨是弱电解质的简要方案___。
【答案】0.375mol/(L·min) ![]() > bd < > c(Cl-)=c(NH4+)>c(H+)=c(OH-) 用玻璃棒蘸取0.1mol·L-1NH4Cl溶液滴在pH试纸上,显色后跟标准比色卡比较,测出pH,pH<7
> bd < > c(Cl-)=c(NH4+)>c(H+)=c(OH-) 用玻璃棒蘸取0.1mol·L-1NH4Cl溶液滴在pH试纸上,显色后跟标准比色卡比较,测出pH,pH<7
【解析】
(1)由图像可知,生成氨气的物质的量为1mol,则消耗氢气的物质的量为1.5mol,反应速率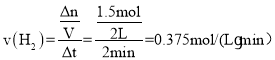 ,故答案为:0.375mol/(L·min);
,故答案为:0.375mol/(L·min);
(2)结合方程式,反应的平衡常数表达式K=![]() ,反应为放热反应,升高温度平衡逆向移动,平衡常数减小,则K1>K2,故答案为:
,反应为放热反应,升高温度平衡逆向移动,平衡常数减小,则K1>K2,故答案为:![]() ;>;
;>;
(3)a.根据方程式系数与反应速率的关系,任何状态下,都有3v(N2)=v(H2),则3v(N2)=v(H2)不能说明反应到达平衡状态,故a错误;
b.从方程式可知,该反应是气体的总物质的量是可变的量,当容器内压强保持不变,则气体的总物质的量不变,说明该反应达到平衡状态,故b正确;
c.根据质量守恒定律,气体的总质量始终保持不变,而该反应在恒容条件下进行,则混合气体的密度始终保持不变,故c错误;
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1,计算浓度熵![]() ,则反应处于平衡状态,故d正确;
,则反应处于平衡状态,故d正确;
综上所述,故答案为:bd;
(4)①中为氨水和盐酸等体积等浓度混合,所得混合溶液中溶质为氯化铵,因为铵根发生水解,则溶液显酸性,pH<7,故答案为:<;
②中两溶液混合后pH=7,因为盐酸为强酸,氨水为弱碱,则需要氨水稍多一些,即氨水的浓度比盐酸的浓度大,c>0.2,因为溶液显中性,则所得混合溶液中各离子浓度大小关系为c(Cl-)=c(NH4+)>c(H+)=c(OH-),故答案为:>;c(Cl-)=c(NH4+)>c(H+)=c(OH-);
(5)若证明一水合氨是弱电解质,则可以从铵根能发生水解来说明,证明方案为:用玻璃棒蘸取0.1mol·L-1NH4Cl溶液滴在pH试纸上,显色后跟标准比色卡比较,测出pH,pH<7,故答案为:用玻璃棒蘸取0.1mol·L-1NH4Cl溶液滴在pH试纸上,显色后跟标准比色卡比较,测出pH,pH<7。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案