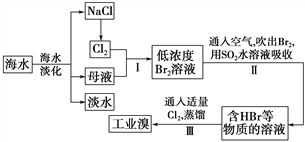
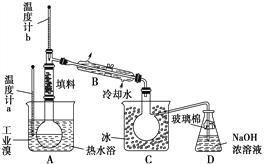
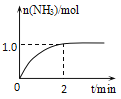
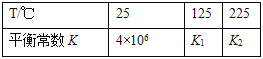
题目内容
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为______,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_____________________________________________ (如果前一问填“是”,此问可以不答)。
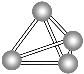
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
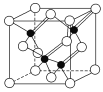
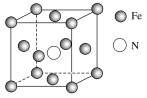
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
【答案】N 16 1 否 30Zn的4s能级有2个电子,处于全满状态,较稳定,第一电离能高于同周期相邻的元素 4 正四面体 Fe4N ![]()
【解析】
(1)根据铬的核外电子排布规律可知,铬的最外层N层上有1个电子,据此答题;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素;
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由4个As原子形成的四面体的体心,据此判断;
(4)根据均摊法确定氮化铁的化学式,根据ρ=m/V计算密度。
(1)铬的核外电子排布式为1s22s22p63s23p63d54s1,所以铬的最外层是N层,有1个电子,N层上原子轨道为s、p、d、f四种,共有轨道数为1+3+5+7=16;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素,30Zn的4s能级有2个电子,处于全满状态,较稳定,所以30Zn与31Ga的第一电离能不符合逐渐增大的规律;
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由4个As原子形成的四面体的体心,所以每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体;
(4)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为8×1/8+6×1/2=4,所以氮化铁的化学式Fe4N,晶胞的体积为a3cm3,所以ρ=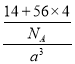 g·cm﹣3=
g·cm﹣3=![]() g·cm﹣3。
g·cm﹣3。

 名校课堂系列答案
名校课堂系列答案