��Ŀ����
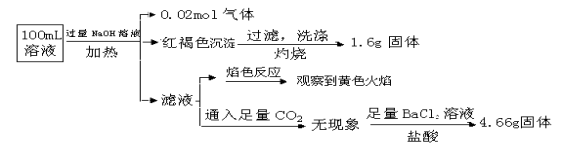
����Ŀ����1��ͼ1��ʾ10mL��Ͳ��Һ���λ�ã�A��B,B��C�̶ȼ����1mL, ����̶�AΪ4��������Һ��������__________mL��
��2��ͼII��ʾ50mL�ζ�����Һ����λ�ã����Һ�洦�Ķ�����a ����ζ�����Һ������������ţ�________��
A. ��amL B.�ǣ�50-a��mL
C. һ������amL D.һ�����ڣ�50-a��mL
��3����ȥ��ʽ�ζ��������ݵķ���Ӧ������ͼ��ʾ�����е�____________��Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��

��4��ʵ���ҳ����ü�ȩ���ⶨ(NH4)2SO4��Ʒ�е��������������䷴Ӧԭ��Ϊ��
4NH4����6HCHO��3H����6H2O��(CH2)6N4H��
�ζ�ʱ��1mol (CH2)6N4H����1mol H���൱��Ȼ����NaOH����Һ�ζ���Ӧ���ɵ��ᡣij��ȤС���ü�ȩ������������ʵ�飺
����I����ȡ��Ʒ1.500g��
�������Ʒ�ܽ����ȫת�Ƶ�250mL����ƿ�У����ݣ����ҡ�ȡ�
�������ȡ25.00mL��Ʒ��Һ��250mL��ƿ�У�����10mL20�������Լ�ȩ��Һ��ҡ�ȡ�����5min����1��2�η�̪��Һ����NaOH����Һ�ζ����յ㡣�����������������ظ�2�Ρ�
��1�����ݲ������գ�
����ʽ�ζ���������ˮϴ�Ӻ�ֱ�Ӽ���NaOH����Һ���еζ���������Ʒ�е����������� ���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
����ƿ������ˮϴ�Ӻ�ˮδ��������ζ�ʱ��ȥNaOH����Һ����� ���ƫ����ƫС������Ӱ�족����
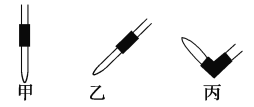
���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲� ��
A �ζ�����Һ��ı仯 B ��ƿ����Һ��ɫ�ı仯
���ζ��ﵽ�յ�ʱ����ָ̪ʾ���� ɫ��� ɫ��
��2���ζ�������±���ʾ��
�ζ����� | ������Һ�� ���/mL | ����Һ����� | |
�ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
��NaOH����Һ��Ũ��Ϊ0.1010mo1��L��1�������Ʒ�е�����������Ϊ ��
���𰸡���1��3.2��2��D��3������4����1����ƫ�� ����Ӱ�� ��B �������ۺ죨��dz�죩��2��18.85��
��������
�����������1����Ͳ���̶����϶�����С������̶�AΪ4��������Һ��������3.2mL��
��2���ζ������̶����϶�����������������Һ�洦�Ķ�����a ����ζ�����Һ������һ�����ڣ�50-a��mL����ѡD��
��3����ȥ��ʽ�ζ��������ݵķ���Ӧ������ͼ��ʾ�����е���������Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��
��4���ټ�ʽ�ζ���������ˮϴ�Ӻ�û����NaOH����Һ��ϴ��ֱ�Ӽ���NaOH����Һ��ʹ�ζ�������������Һ��Ũ��ƫС���������������Ʊ���Һ����жϣ��ò����Ʒ��(CH2)6N4H��ƫ�࣬��˽��������������ƫ�ߣ�
����ƿ������ˮϴ�Ӻ�ˮδ������������Һ�к��еı��̶ȵ����ʵ����ʵ������䣬��ζ�ʱ��ȥNaOH����Һ�����Ҳ���䣬��˲�������κ�Ӱ�죻
�۵ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲���ƿ����Һ��ɫ�ı仯����ѡ��B��ȷ��
������ָʾ����̪������Һ�У�����֪Ũ�ȵļ�ζ�δ֪Ũ�ȵ��ᣬ��˿�ʼ��Һ����ɫ�����ζ��ﵽ�յ�ʱ����ָ̪ʾ������ɫ���dz��ɫ��
��5������ʵ���֪��һ��ʵ�鷴Ӧ���ı���Һ�����21.03mL-1.02mL��20.01mL���ڶ���ʵ�鷴Ӧ���ı���Һ�����21.99mL-2.00mL��19.99ml��������ʵ�鷴Ӧ���ı���Һ�����20.20mL-0.20mL��20.00ml����˷�Ӧ���ı���Һ�������V��(20.01mL+19.99ml+20.00ml)��3��20.00mL�������ᡢ����кͷ�Ӧʱ�����ʵ�����ϵ��1:1��֪��c��25.00mL��0.1010 mol��L��1��20.00mL�����c��0.0808mol/L����250mL��Һ�к���(CH2)6N4H����H+�����ʵ�����0.0808mol/L��0.25L��0.0202mol������1.500 g��Ʒ�к�NH4+�����ʵ�����0.0202mol�����к���N��������m(N)��0.0202mol��14g/mol��0.2828g������NԪ�ص����������ǣ�0.2828g��1.500 g����100%��18.85%��

 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�