题目内容
【题目】向Cu、Cu2O和CuO组成的混合物中,加入1L0.6 mol/L HNO3溶液恰好使其完全溶解,同时收集到2240 mL NO气体(标准状况)。下列说法中不正确的是
(已知:Cu2O+2H+=Cu+Cu2++H2O)
A. 上述体现酸性的硝酸与体现氧化性的硝酸其物质的量之比为5:1
B. 若混合物中含0.1molCu,使该混合物与稀硫酸充分反应,消耗硫酸的物质的量为0.1mol
C. Cu2O跟稀硝酸反应的离子方程式为:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O
D. 若将上述混合物用足量的H2加热还原,所得到固体的质量为32g
【答案】D
【解析】
A. 标况下2.24LNO的物质的量为:![]() =0.1mol,则被还原体现氧化性的硝酸的物质的量为0.1mol;参加反应的硝酸的总物质的量为:0.6mol/L×1L=0.6mol,根据N原子守恒,体现酸性的硝酸的物质的量为:0.6mol0.1mol=0.5mol,所以体现酸性的硝酸与体现氧化性的硝酸其物质的量之比为:0.5mol:0.1mol=5:1,故A正确;
=0.1mol,则被还原体现氧化性的硝酸的物质的量为0.1mol;参加反应的硝酸的总物质的量为:0.6mol/L×1L=0.6mol,根据N原子守恒,体现酸性的硝酸的物质的量为:0.6mol0.1mol=0.5mol,所以体现酸性的硝酸与体现氧化性的硝酸其物质的量之比为:0.5mol:0.1mol=5:1,故A正确;
B. 根据电子转移守恒,混合物中n(Cu2O)=![]() =0.05mol,再结合B中Cu元素物质的量根据Cu守恒可知:n(CuO)=0.25mol0.1mol0.05mol×2=0.05mol,混合物中,0.1molCu不与稀H2SO4反应,0.05molCu2O、0.05molCuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4电离的H+生成H2O,可得消耗的n(H2SO4)=0.05mol+0.05mol=0.1mol,故B正确;
=0.05mol,再结合B中Cu元素物质的量根据Cu守恒可知:n(CuO)=0.25mol0.1mol0.05mol×2=0.05mol,混合物中,0.1molCu不与稀H2SO4反应,0.05molCu2O、0.05molCuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4电离的H+生成H2O,可得消耗的n(H2SO4)=0.05mol+0.05mol=0.1mol,故B正确;
C. Cu2O被稀HNO3氧化为Cu2+,NO3被还原为NO,同时生成H2O,其反应的离子方程式为:3Cu2O+14H++2NO3═6Cu2++2NO↑+7H2O,故C正确;
D. Cu、Cu2O、CuO与HNO3恰好完全反应时生成Cu(NO3)2、NO和H2O,硝酸的物质的量0.6mol,NO的物质的量=0.1mol,根据N原子守恒可知:n[Cu(NO3)2]=0.6mol0.1mol2=0.25mol,混合物中所含的Cu元素共有0.25mol,根据铜元素守恒可知,用H2还原Cu、Cu2O、CuO混合物后应得到0.25molCu,故固体的质量为:0.25mol×64g/mol=16g,故D错误;
答案选D。

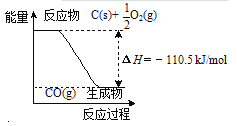
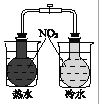
【题目】下列图示与文字叙述相符合的是
A | B |
|
|
12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ | 热水浴的烧瓶中气体颜色较浅 |
C | D |
|
|
验证AgCl溶解度大于Ag2S | 钢闸门作为阴极而受到保护 |
A. AB. BC. CD. D
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|