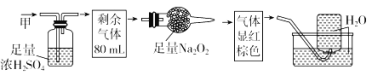
题目内容
【题目】现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O
2MgO+C;④Mg+H2O![]() MgO+H2↑;⑤Mg3N2+6H2O
MgO+H2↑;⑤Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。


回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是_____;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?____,原因是____;
(4)请设计一个实验,验证产物是氮化镁:___。
【答案】B、目的是除气流中的水蒸汽,避免反应④发生;D、目的是除空气中的CO2,避免反应③发生;F、目的是除空气中的氧气,避免反应①发生; j→h→g→d→c→k→l(或l→k)→a→b(或b→a) 使氮化镁不纯 如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁 取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
【解析】
(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,灼热的铜粉为了除去空气中氧气;
故答案为:B目的是除气流中的水蒸汽,避免反应④发生;D目的是除去空气中的CO2,避免反应③发生;F目的是除去空气中的氧气,避免反应①发生;
(2)气体参与的物质制备实验中装置的连接一般顺序是:制备气体→除杂→干燥→制备→尾气处理;所以除去空气中的O2、CO2、H2O制备氮化镁,装置连接顺序是,j→h→g→d→c→k→l(或l→k)→a→b(或b→a);
故答案为:j→h→g→d→c→k→l(或l→k)→a→b(或b→a);
(3)因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应,如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁;
故答案为:制得的氮化镁将不纯;如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁;
(4)依据氮化镁和水反应生成氨气,方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁;
故答案为:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁;

 小题狂做系列答案
小题狂做系列答案【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl)生产CuCl的流程:
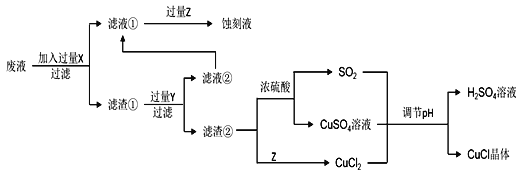
根据以上信息回答下列问题:
(1)生产过程中X的化学式为____。
(2)写出产生CuCl的离子方程式:____。
(3)实验探究pH对CuCl产率的影响如表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为____,当pH较大时CuCl产率变低原因是____。调节pH时,___(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是____。
(4)氯化亚铜的定量
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_____。(结果保留三位有效数字)。
(5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。