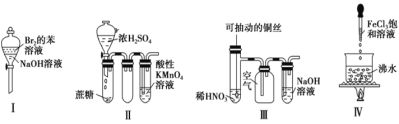
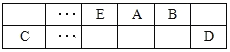
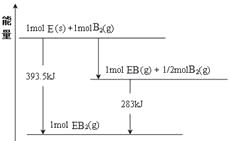
题目内容
【题目】下列实验的反应原理及对应的离子方程式均正确的是
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-=2AlO2-+H2↑
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
【答案】A
【解析】
A、室温下测得氯化铵溶液的pH<7,则溶液中存在平衡:NH4++H2O![]() NH3·H2O+H+,可证明一水合氨是弱碱,故A正确;
NH3·H2O+H+,可证明一水合氨是弱碱,故A正确;
B.该反应不满足电子守恒,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C、酸性KMnO4溶液具有强氧化性,能够氧化氯离子,不能用盐酸酸化,可以选用硫酸,故C错误;
D、草酸为弱电解质,离子方程式中需要保留分子式,正确的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故D错误;
故选A。

【题目】盐酸与碳酸钙反应生成CO2,运用下图,可测定该反应的速率.请根据要求填空:
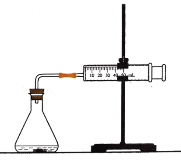
(1)连接好仪器后,需要检查_____________________,再加入药品进行实验.
(2)在锥形瓶中加入5g大理石,加入20mL 1mol·L1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反应速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”处应填的数据是_________________.
(3)从反应速率随时间变化的数据可知,本实验中反应速率与___________和__________有关