题目内容
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为____________。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a____b(填“>"或“<”或“=”)
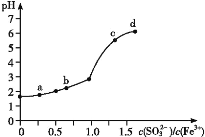
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:_______________填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:________________。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是________。
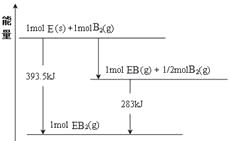
(6)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式__________。
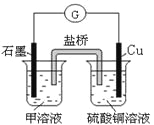
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为_________________。
【答案】NH3·H2O![]() NH4++ OH- > Al(OH)3 ①③ Na3N + 4H2O=3NaOH + NH3·H2O CO2(g) + C(s) =2CO(g) △H= +172.5kJ/mol或
NH4++ OH- > Al(OH)3 ①③ Na3N + 4H2O=3NaOH + NH3·H2O CO2(g) + C(s) =2CO(g) △H= +172.5kJ/mol或![]() CO2(g) +
CO2(g) + ![]() C(s) =CO(g) △H=+86.25kJ/mol Fe3++e-=Fe2+
C(s) =CO(g) △H=+86.25kJ/mol Fe3++e-=Fe2+
【解析】
A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,该离子化合物为铵盐,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,据此解答。
根据题意可推知:A是N;B是O;C是Na;D是Cl;E是C;F是Al;G是Fe,
(1)NH3的水溶液显碱性,能使酚酞变红,是因为在溶液中存在:NH3+H2O![]() NH3·H2O;故答案是: NH3·H2O
NH3·H2O;故答案是: NH3·H2O![]() NH4++ OH-;
NH4++ OH-;
(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b;
(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;
(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾;
(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O.;
(6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) =2CO(g) ;△H= +172.5kJ/mol;
(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,铜做负极,正极材料为石墨,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-=Fe2+。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案