题目内容
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。
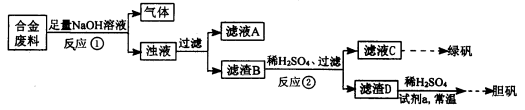
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
①实验①最先溶解的金属发生反应的化学方程式是 。
②滤渣B中Fe的质量分数为____%(精确到0.1%)。

请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
(1)Cu(1分)(2)H2O2(或O3)(1分)Cu+H2O2+H2SO4=CuSO4+2H2O
(2分)(3) 逐滴滴加稀盐酸(或稀硫酸)至过量(1分),若先有白色沉淀(1分),然后沉淀完全溶解(1分)SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-(2分)
(4)①3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O(2分)②63.6%(2分)
(2分)(3) 逐滴滴加稀盐酸(或稀硫酸)至过量(1分),若先有白色沉淀(1分),然后沉淀完全溶解(1分)SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-(2分)
(4)①3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O(2分)②63.6%(2分)
试题分析:(1)结合产物判断流程中生成蓝矾,说明B中含有铜,即该合金中一定含有Fe和Cu。
(2)双氧水(或臭氧)是一种常见的绿色氧化剂,在双氧水的作用下,金属铜在硫酸中被氧化生成硫酸铜,发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O或Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O。
(3)由于偏铝酸钠与硅酸钠均与酸反应生成白色沉淀,但偏铝酸钠生成的氢氧化铝是两性氢氧化物可以溶解在酸中。但硅酸钠生成的硅酸不能溶解在酸中,据此可以鉴别二者。则验证滤液A只含NaAlO2、不含Na2SiO3的方法是取少量滤液A于试管中,滴加盐酸,开始生成白色沉淀为氢氧化铝,继续滴加盐酸,氢氧化铝会溶解生成氯化铝,无白色沉淀现象证明不含硅酸钠;碳酸酸性大于硅酸,因此过量二氧化碳通入硅酸钠溶液中,反应生成硅酸沉淀和碳酸氢钠,反应的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。
(4)①由于铁的还原性大于铜,所以铁首先与硝酸发生氧化还原反应,因此实验①中发生反应的化学方程式为3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O。
②由①、②两组数据分析,①组实验中金属过量,硝酸不足。①中溶解金属的质量=13.2g-9.0g=4.2g,此时生成1.12LNO气体,物质的量=1.12L÷22.4L/mol=0.05mol(转移0.05mol×3=0.15 mol电子)。由于金属有剩余,则生成的应该是亚铁离子。若只溶解铁,则铁的物质的量=0.15mol÷2=0.075mol,质量为0.075mol×56g/mol=4.2gg。若只溶解铜,铜的物质的量=0.15mol÷2=0.075mol,质量为0.075mol×64g/mol=4.8g。由此可知,实验①中恰好溶解了4.2g金属铁。根据实验②可知,②比①又多溶解了9.0g-4.8g=4.2g金属,而②比①多生成了2.24L-1.21L=1.12LNO气体,这说明实验②中共恰好溶解了8.4g金属铁。而根据③比②多生成了3.36L-2.24L=1.12LNO气体可知,剩余的4.8g金属全部是Cu。实验④比③又多生成了1.12LNO,这是由于发生了反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。由此可知滤渣中铁的质量分数=
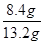 ×100%=63.6%。
×100%=63.6%。
练习册系列答案
相关题目
 2KNO2+O2↑
2KNO2+O2↑ 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑ 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑


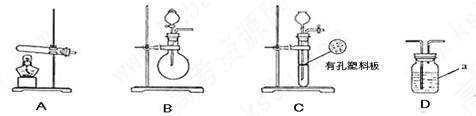
 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积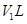 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。 