题目内容
17.(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol.(2)已知下列热化学方程式:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H1=-351.1kJ/mol;Hg(l)+$\frac{1}{2}$O2(g)=HgO(s)△H2=-90.7kJ/mol.
由此可知:Zn(s)+HgO(s)=ZnO(s)+Hg(l)△H3=-260.4kJ•mol-1.
分析 (1)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
(2)据盖斯定律,反应热与反应的途径无关,只与起始状态、最终状态有关,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减,据此计算.
解答 解:(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;
(2)由①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-351.1kJ•mol-1,
②Hg(1)+$\frac{1}{2}$O2(g)=HgO(s)△H=-90.7kJ•mol-1,
则根据盖斯定律可知,①-②得Zn(s)+HgO(s)═ZnO(s)+Hg(1),
所以△H=(-351.1kJ•mol-1)-(-90.7kJ•mol-1)=-260.4 kJ•mol-1,
故答案为:-260.4kJ•mol-1.
点评 本题考查学生利用盖斯定律计算反应热,题目难度不大,关键在于设计反应过程,构造出目标反应式.

练习册系列答案
相关题目
7.用密度为ρ1g/cm3质量分数是ω的浓盐酸,与水配制成体积比为1:4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度( )
| A. | $\frac{1000{ρ}_{1}{ρ}_{2}ω}{182.5}$mol/L | B. | $\frac{1000{ρ}_{1}{ρ}_{2}ω}{{ρ}_{1}+4}$mol/L | ||
| C. | $\frac{1000{ρ}_{1}{ρ}_{2}ω}{36.5({ρ}_{1}+4)}$mol/L | D. | $\frac{1000{ρ}_{1}ω}{182.5}$mol/L |
5.下列离子方程式书写正确的是( )
| A. | 氯水和碘化钾反应:Cl2+I-═Cl-+I2 | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
12.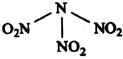 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 该物质既有氧化性又有还原性 | |
| B. | 分子中四个氮原子共平面 | |
| C. | 分子中N、O间形成的共价键是非极性键 | |
| D. | 15.2g该物质含有6.02×1022个原子 |
9.下列物质中属于氧化物的是( )
| A. | O2 | B. | Na2O | C. | NaCl | D. | SO2 |
6.某有机物的相对分子质量为74,红外光普图如下,其结构可确定为( )


| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2OCH2CH2CH3 | ||
| C. | (CH3)2CH2OCH2(CH3)2 | D. | CH3CH2OCH2CH3 |
12.120℃时,0.1mol两种气态烃组成的混合气体完全燃烧后得到8.8gCO2和3.6g水,则这两种烃可能是下列的( )
| A. | CH4和C3H4 | B. | C2H2和C2H6 | C. | CH4和C3H6 | D. | CH4和C2H6 |