题目内容
8.酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法.现用0.1000mol•L-1的标准盐酸去滴定20.00mL 某未知浓度的NaOH溶液,请填写下列空白:1有关数据记录如下:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 1.20 | 21.18 |
| 3 | 20.00 | 0.80 | 24.20 |
(2)若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(选填“偏高”、“偏低”或“不影响”).若读数时,滴定前仰视,滴定后俯视,则测定结果将偏低.
分析 (1)第三次实验有误差,HCl溶液体积比第一次和第二次大太多,舍去,然后求出另外两组的平均值,最后根据关系式HCl~NaOH来计算出NaOH的浓度;
(2)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$来判断不当操作对相关物理量的影响.
解答 解:(1)第三次实验有误差,HCl溶液体积比第一次和第二次大太多,舍去,另外两组的平均值为V(HCl)=$\frac{(20.52-0.50)+(21.18-1.20)}{2}$=20.00mL,
则c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$=$\frac{0.1000mol•{L}^{-1}×0.020L}{0.020L}$=0.10mol•L-1,
故答案为:0.10;
(2)若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则消耗的标准溶液的体积偏大,由c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,测定结果将偏高;
若读数时,滴定前仰视,滴定后俯视,则消耗的标准溶液的体积偏小,由c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,测定结果将偏低;
故答案为:偏大,偏低.
点评 本题主要考查了滴定操作及误差分析,题目难度不大,侧重于考查学生的实验操作能力和数据处理能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某卤代烃中化学键如图所示,则下列说法正确的是( )
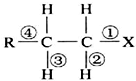

| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
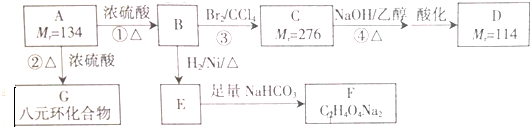
16.工业上设计将VOSO4、SO2杂质除去并回收得到V2O5的流程如下:
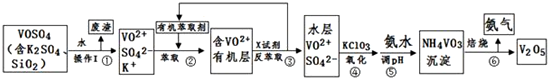
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为1.7-1.8.
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.

请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作Ⅰ的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率.
③中X试剂为H2SO4.
(3)④的离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+.
(4)25℃时,取样进行试验分 析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3mol•L-1.(已知:25℃时,K电[Fe(OH)3]=2.6×10-33)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
3.同分异构体现象是有机化学中的一种普便现象,下列有关同分异构体叙述中正确的是( )
| A. | 分子式相同而结构式不同的化合物互称同分异构体 | |
| B. | 组成元素相同而结构式不同的物质互称同分异构体 | |
| C. | 互为同分异构体的物质性质相同 | |
| D. | 互为同分异构体的物质性质相异 |
13.已知汽车尾气无害化处理反应为:2NO(g)+2CO(g)═N2(g)+2CO2(g),下列说法不正确的是( )
| A. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 升高温度可使该反应的逆反应速率降低 |
20.咖啡酸的结构简式为,
现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸化的高锰酸钾溶液 ⑥新制氢氧化铜悬浊液.试根据其结构特点判断在一定条件下能与咖啡酸反应的物质组合是( )

现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸化的高锰酸钾溶液 ⑥新制氢氧化铜悬浊液.试根据其结构特点判断在一定条件下能与咖啡酸反应的物质组合是( )
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
18.反应4A(g)+5B(g)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为( )
| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.060mol/(L•s) |