题目内容
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
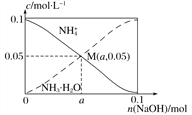
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
【答案】B
【解析】n(Na+)=amol,n(NH4+)=0.05mol,n(Cl-)=0.1mol根据电荷守恒,n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+);n(OH-)-n(H+)=n(Na+)+n(NH4+)-n(Cl-)=(a-0.05)mol,故A正确;  不变,随着NaOH的加入,
不变,随着NaOH的加入,![]() 不断增大,所以
不断增大,所以![]() 增大,
增大,  ,
,![]() ,
, 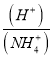 不断减小,故B错误;向氯化铵溶液中加碱,对水的电离起抑制作用,所以M点溶液中水的电离程度比原溶液小,故C正确;当n(NaOH)=0.1mol时,
不断减小,故B错误;向氯化铵溶液中加碱,对水的电离起抑制作用,所以M点溶液中水的电离程度比原溶液小,故C正确;当n(NaOH)=0.1mol时,![]() ,c(OH-)=c(Cl-)-c(NH3H2O)+c(H+),所以c(OH-)>c(Cl-)-c(NH3H2O),故D正确。
,c(OH-)=c(Cl-)-c(NH3H2O)+c(H+),所以c(OH-)>c(Cl-)-c(NH3H2O),故D正确。

练习册系列答案
相关题目