题目内容
【题目】SO2在工业生产和食品加工等行业用途广泛。某化学小组对SO2的一些性质和反应进行探究。回答下列问题:
I.为探究SO2和Na2O2的反应产物,进行如下实验。
(1)提出假设。假设一:反应产物为Na2SO3和O2;假设二:反应产物为___(填化学式)。
(2)实验验证。
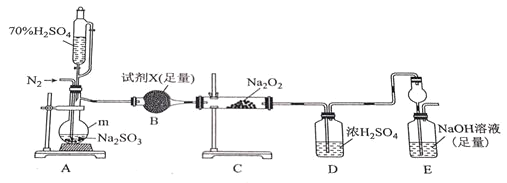
①m的名称为___。
②A中若用稀硫酸代替70%的硫酸,不足之处为___。
③试剂X不宜选择___(填选项字母)。
a.生石灰 b.CaCl2 c.硅胶 d.P2O5
④B的作用___。
II.SO2可以用作葡萄酒的抗氧化剂和防腐剂。该小组同学通过下列操作测定某葡萄酒样品SO2的总含量:量取V1mL样品,加入足量稀H2SO4;将生成的SO2全部蒸出并用足量NaOH溶液吸收;调节溶液的pH后,用cmol/L的标准I2溶液滴定至终点,消耗标准液的体积为V2mL。
(3)滴定反应的离子方程式为___;样品中的总含量为___mg/L(用含c,V1,V2的代数式表示)。
(4)若用足量稀盐酸代替稀H2SO4,会导致所测SO2的总含量___(填偏高偏低或无影响)。
III.(5)设计实验证明H2SO3的酸性强于H2CO3:___。(供选试剂:NaHCO3溶液、CO2、SO2、KMnO4(H+)溶液、NaOH溶液、澄清石灰水)
【答案】Na2SO4 蒸馏烧瓶 导致SO2溶解损失,降低反应速率 a 干燥SO2气体 SO32-+I2+H2O=SO42-+2I-+2H+ ![]() 无影响 将SO2先通入NaHCO3溶液,再将所得气体通过足量KMnO4(H+)溶液除去SO2,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明H2SO3的酸性强于H2CO3
无影响 将SO2先通入NaHCO3溶液,再将所得气体通过足量KMnO4(H+)溶液除去SO2,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明H2SO3的酸性强于H2CO3
【解析】
(1)利用Na2O2具有强氧化性,SO2具有还原性,进行分析;
(2)①根据仪器特点,得出仪器的名称;
②利用SO2易溶于水,浓度对反应速率的影响;
③装置A中气体为SO2,利用SO2为酸性氧化物,进行分析;
④因为Na2O2能与水反应,因此装置B的作用是干燥SO2;
(3)SO2被NaOH吸收,得到Na2SO3,利用I2的氧化性将SO32-氧化成SO42-,书写出氧化还原反应;根据反应方程式,求出结果;
(4)盐酸具有挥发性,蒸出的SO2中混有HCl,干扰实验;
(5)利用酸性强的制取酸性弱的。
(1)过氧化钠具有强氧化性,二氧化硫具有还原性,据此可知,反应产物还可能是![]() ,故答案为:
,故答案为:![]() ;
;
(2)![]() 的名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
的名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
![]() 二氧化硫能溶于水,使用稀硫酸,会导致
二氧化硫能溶于水,使用稀硫酸,会导致![]() 溶解而损失,同时反应物浓度减小,化学反应速率减缓,
溶解而损失,同时反应物浓度减小,化学反应速率减缓,
故答案为:导致![]() 溶解损失,降低反应速率
溶解损失,降低反应速率![]() 答出一点即可
答出一点即可![]() ;
;
![]() 试剂X的作用是干燥二氧化硫,二氧化硫能与碱或碱性氧化物反应,不能使用氧化钙干燥,故a符合题意,
试剂X的作用是干燥二氧化硫,二氧化硫能与碱或碱性氧化物反应,不能使用氧化钙干燥,故a符合题意,
故答案为:a;
![]() 的作用是干燥
的作用是干燥![]() 气体,故答案为:干燥
气体,故答案为:干燥![]() 气体;
气体;
(3)二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠能被碘单质氧化为硫酸钠,则滴定反应的离子方程式为![]() ;滴定过程中消耗的碘单质的物质的量为
;滴定过程中消耗的碘单质的物质的量为![]() ,由离子反应方程式可知,溶液中的
,由离子反应方程式可知,溶液中的![]() ,由S元素的守恒可知样品中
,由S元素的守恒可知样品中![]() 的物质的量为
的物质的量为![]() ,则样品中的
,则样品中的![]() 总含量为
总含量为![]() =
=![]() ;
;
故答案为:![]() ;
;![]() ;
;
(4)盐酸的酸性强于亚硫酸,故使用稀盐酸代替稀硫酸不影响二氧化硫的生成,且挥发出来的氯化氢也不与碘单质反应,故使用稀盐酸代替稀硫酸对所测![]() 的总含量不影响,
的总含量不影响,
故答案为:不影响;
(5)利用强酸制弱酸的原理可证明不同酸的酸性强弱,证明![]() 的酸性强于
的酸性强于![]() 具体实验为将
具体实验为将![]() 先通入
先通入![]() 溶液,再将所得气体通过足量
溶液,再将所得气体通过足量![]() 溶液除去
溶液除去![]() ,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明
,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明![]() 的酸性强于
的酸性强于![]() 。
。
故答案为:将![]() 先通入
先通入![]() 溶液,再将所得气体通过足量
溶液,再将所得气体通过足量![]() 溶液除去
溶液除去![]() ,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明
,最后将气体通入澄清石灰水中,澄清石灰水变浑浊,证明![]() 的酸性强于
的酸性强于![]() 。
。

【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。