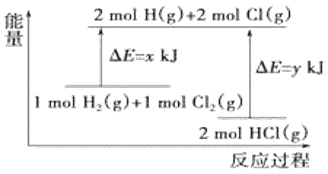
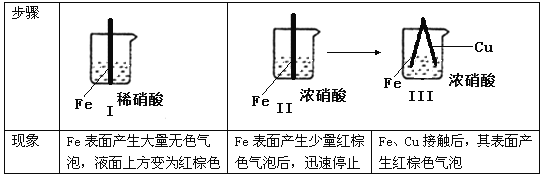
题目内容
【题目】光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF![]() 使酸性大大增强。HF
使酸性大大增强。HF![]() 的结构式为___;H3BO3和BF
的结构式为___;H3BO3和BF![]() 中,B原子的杂化类型分别为___、__。
中,B原子的杂化类型分别为___、__。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___。

②BeO晶胞中,O的堆积方式为____;设O与Be的最近距离为acm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为____g·cm-3。
【答案】C Be原子和B原子价层电子数均小于价层轨道数,存在空轨道 KF为离子晶体,而BF3为分子晶体,离子晶体的熔沸点大于分子晶体 ![]() sp2 sp3 KBe2BO3F2 D 面心立方最密堆积
sp2 sp3 KBe2BO3F2 D 面心立方最密堆积 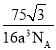
【解析】
(1)不同轨道的电子具有不同能量,发生跃迁时发出不同波长的光;
(2)Be、B原子有空轨道更容易与配体形成配位键
(3)离子键的键能大于共价键;
(4)根据VSEPR模型计算中心原子的孤对电子数和价层电子数来判断杂化类型和分子空间构型;
(5)看单个晶胞单元内含有各原子个数;
(6)①根据晶胞结构分析,Be做面心立方最密堆积;
②根据晶胞密度![]() 分析,以一个晶胞有4个Be原子、4个O原子计算晶胞质量,再用数学空间几何来运算晶胞棱长,进而的晶胞体积;
分析,以一个晶胞有4个Be原子、4个O原子计算晶胞质量,再用数学空间几何来运算晶胞棱长,进而的晶胞体积;
(1)激发态1s22s13s1的铍原子回到基态1s22s2,3s上的1个电子可能回到1s轨道有2种情况,2s轨道有1种情况,故最多可发出3种不同波长的光,答案选C;
(2)Be原子的价电子为2s2,轨道表达式![]() ,B原子的价电子为2s22p1,轨道表达式
,B原子的价电子为2s22p1,轨道表达式![]() ,Be原子和B原子价层电子数均小于价层轨道数,存在空轨道;
,Be原子和B原子价层电子数均小于价层轨道数,存在空轨道;
(3)KF是含有离子键的离子化合物, BF3是含有共价键的共价化合物,离子键的键能大于共价键,故KF的沸点比BF3的高;
(4)HF![]() 的H孤电子对数
的H孤电子对数![]() ,价电子对数
,价电子对数![]() ,分子构型为直线型,且H原子与F原子之间有氢键,结构式为:
,分子构型为直线型,且H原子与F原子之间有氢键,结构式为:![]() ,H3BO3中中心原子B的电子对数为:
,H3BO3中中心原子B的电子对数为:![]() ,属于sp2杂化,BF
,属于sp2杂化,BF![]() 中中心原子B的电子对数为:
中中心原子B的电子对数为:![]() ,属于sp3杂化;
,属于sp3杂化;
(5)从图1来看,一个单元内含有2个Be原子、1个B原子、3个O原子、2个F原子,故KBeBF晶体的化学式为KBe2BO3F2;
(6)①晶胞沿着对角线方向可以观察到六边形,中心O与Be重合,外侧大正六边形均为Be原子构成,内部小正六边形由3个Be原子、3个O原子间隔形成,所以得到投影结果为D;
从图中可以看出每个面的面心均有O原子,顶点上各有一个O原子,为面心立方最密堆积;②一个晶胞中,单独含有O原子的数目为![]() ,单独含Be原子数目有4个,晶胞质量
,单独含Be原子数目有4个,晶胞质量![]() ,晶胞中白色球周围最近的4个黑色球构成正四面体,白色球处于正四面体的中心,顶点黑色球与正四面体中心白色球连线处于晶胞对角线上,由几何知识可知晶胞体对角线长度为4acm,则晶胞棱长为
,晶胞中白色球周围最近的4个黑色球构成正四面体,白色球处于正四面体的中心,顶点黑色球与正四面体中心白色球连线处于晶胞对角线上,由几何知识可知晶胞体对角线长度为4acm,则晶胞棱长为![]()
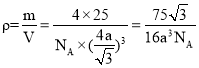 。
。

【题目】生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______(填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
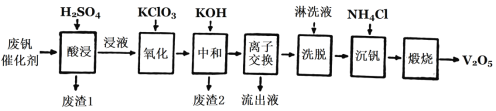
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________,同时V2O5转化为VO2+。“废渣1”的主要成分是________。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____。
(6)“煅烧”中发生反应的化学方程式2NH4VO3![]() V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__kg(保留小数点后一位)。