题目内容
几种短周期元素的原子半径及主要化合价如下表 ( )
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.标准状况下1L 1mol·L-1的YP3溶液中含有NA个Y3+离子
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.标准状况下1L 1mol·L-1的YP3溶液中含有NA个Y3+离子
D
试题分析:根据元素的主要化合价进行归类,X、N化合价为+1价,可以推断出X、N均处于ⅠA,Y处ⅢA,Z处于ⅤA,M为-2价,那么应处于ⅥA,只能是O元素,S还有+4、+6价。P应处于ⅦA,只能是Cl元素,F只有-1价。再根据原子半径大小关系,同周期从左到右原子半径逐渐减小,同主族从上打下逐渐增大,可以判断,N是Li元素,不可能是H元素(H原子半径最小),X是Na元素。同周期原子半径从左到右逐渐减小,同时结合主要化合价进行考虑可以得出:Y是Al元素(只有正价),Z是N元素,不可能是P元素,因为氧元素下一周期的半径会大于Z元素。所以综上可以得出各元素分别为:X是Na元素,Y是Al元素,Z是N元素,M是O元素,N是Li元素,P是Cl元素。A.同主族金属性从上到下逐渐增强,所以金属性应有Na>Li。故A正确。B.工业上冶炼Al元素是采用电解Al2O3(加入冰晶石降低熔点)故B正确。C.Na在O2中燃烧生成Na2O2,1mol Na2O2含有1mol O22-,39g Na2O2为0.5mol。故C正确。D.1molAlCl3溶液中,Al3+会发生水解,所以Al3+<NA。A的判断

练习册系列答案
相关题目

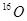 与
与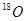 互为同位素:
互为同位素: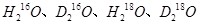 互为同素异形体
互为同素异形体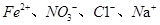 能够大量共存
能够大量共存