题目内容
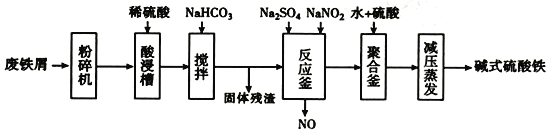
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:
已知:
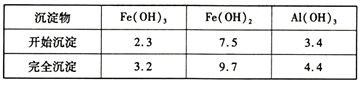
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)粉碎过筛的目的是____________________。
(2)加入少量NaHCO3的目的是________。
(3)反应釜中发生反应的离子方程式为_______________________。在实际生产中,常同时通入02以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为________。
(4)聚合釜中溶液的PH必须控制在一定的范围内。PH偏小时Fe3+水解程度弱,PH偏大时则_____________________________________。
(5)采取减压蒸发的原因是___________________________________。
【答案】 增大反应物接触面积,提高“酸浸”反应速率 调节PH,使溶液中的Al3+沉淀 2H++Fe2++ NO2-=Fe3++NO↑+H20 2mol 形成氢氧化铁沉淀 温度过高,碱式硫酸铁分解
【解析】(1)为提高“酸浸”反应速率,可通过将固体粉碎过筛达到选取细小颗粒,增大反应接触面积来实现。
(2)为了使Fe3+和Al3+完全分离,可通过加入少量NaHCO3来调节溶液pH,使溶液中的Al3+完全沉淀;
(3)反应釜中Fe2+在酸性条件下被NO2-氧化为Fe3+,同时得到还原产物NO时发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O,n(O2)=![]() =0.5mol,则得到电子0.5mol×4=2mol,1mol NaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2mol NaNO2;
=0.5mol,则得到电子0.5mol×4=2mol,1mol NaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则需要2mol NaNO2;
(4)为防止Fe3+水解生成Fe(OH)3沉淀,产物不纯,调节溶液pH时不易过大;
(5)蒸发时选择减压蒸发,可降低沸点,避免高温下碱式硫酸铁分解。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
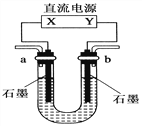
选项 | 电源 X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-===2H2O+O2↑ |
C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
D | 负极 | Fe(OH)3胶体和导电液 | b管中液体颜色加深 |
A. A B. B C. C D. D

