题目内容
【题目】用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
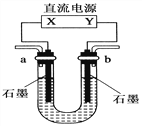
选项 | 电源 X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-===2H2O+O2↑ |
C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
D | 负极 | Fe(OH)3胶体和导电液 | b管中液体颜色加深 |
A. A B. B C. C D. D
【答案】C
【解析】A. b管中电极为阴极,发生反应:2H2O+2e-=H2↑+2OH-,所以b管中溶液呈红色,故A错误;B a管中电极为阳极,a管中电极反应式是4OH--4e-===2H2O+O2↑,故B错误;C. a管中电极是阴极,发生反应:Cu2++2e-=Cu,2H2O+2e-=H2↑+2OH-,b管中电极是阳极,发生反应:2Cl--2e-=Cl2↑,2H2O-4e-=O2↑+4H+,相同条件下,a、b两管中产生的气体总体积可能相等,故C正确;D. Fe(OH)3胶体胶粒带正电,a管中电极是阴极,胶粒移向阴极,所以a管中液体颜色加深,故D错误。故选C。

练习册系列答案
相关题目