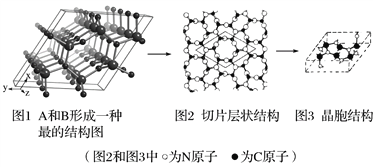
题目内容
【题目】下列说法正确的是
A. NaHCO3分解过程中,只需克服离子键
B. Na2O溶于水的过程中破坏了离子键和共价键,形成了新的离子键和共价键
C. O3、CO2和SiO2都是由分子构成的
D. 金刚石和足球烯(C60)均为原子晶体,沸点极髙
【答案】B
【解析】A. NaHCO3分解生成碳酸钠、二氧化碳和水,需克服离子键和共价键,故A错误;B. Na2O溶于水反应生成氢氧化钠,过程中破坏了氧化钠中离子键和水中的共价键,形成了新的离子键和共价键,故B正确;C. SiO2属于原子晶体,是由原子构成的,故C错误;D.足球烯(C60)为分子晶体,故D错误;故选B。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目