题目内容
【题目】铁及其化合物是中学化学中常见的物质。
(1)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作________(填 “阳”或“阴”)极,铜离子向________极移动,阴极的电极反应式为________。
(2)常温时,FeCl3溶液pH<7,原因是(用离子方程式表示)________。
(3)将0.1mol·L-1 FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为________。
【答案】阳 阴 Cu2++2e-=Cu Fe3+ +3H2O![]() Fe(OH)3 +3H+ 2Fe3++3Mg(OH)2= 2Fe(OH)3 +3Mg2+
Fe(OH)3 +3H+ 2Fe3++3Mg(OH)2= 2Fe(OH)3 +3Mg2+
【解析】
(1)根据电镀原理解答;根据水解原理完成水解反应方程式;根据沉淀溶解平衡原理完成沉淀转化反应方程式;
(1)根据电镀原理,以CuSO4溶液为电解液,铁件表面镀铜,可用铜作阳极,铁件做阴极,电解液中铜离子向阴极移动,阴极的电极反应式为Cu2++2e-=Cu;
(2)常温时,FeCl3为强酸弱碱盐,弱根离子会发生水解,其离子方程式为:Fe3++3H2O ![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(3)将0.1mol·L-1 FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生,说明有Fe(OH)3生成,所以该变化的离子方程式为2Fe3++3Mg(OH)2= 2Fe(OH)3+3Mg2+。

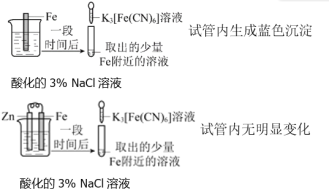
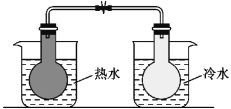
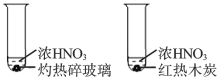
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
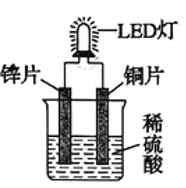
A |
| Zn保护了Fe不被腐蚀 |
B |
| 2NO2(g) |
C | 试管内均有红棕色气体生成
| 木炭与浓硝酸发生了反应 |
D | 常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,充分搅拌后过滤,再向洗净的滤渣中加稀盐酸,有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
A. AB. BC. CD. D