题目内容
【题目】根据下表给出的几种物质的熔沸点数据,判断下列说法中错误的是
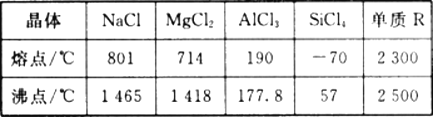
A. SiCl4 和A1Cl3都是分子晶体 ,熔融状态下不导电
B. MgCl2和NaCl都是离子晶体,熔融状态能导电且易溶于水
C. 若单质R是原子晶体,其熔沸点的高低是由共价键的键能决定的
D. 固态时可导电的一定是金属晶体
【答案】D
【解析】
不同晶体的熔沸点比较:原子晶体>离子晶体>>分子晶体。故可以通过晶体的熔沸点判断出该晶体的类型。即NaCl、MgCl2为离子晶体,AlCl3、SiCl4为分子晶体。R可能为原子晶体。
A. 相比之下,AlCl3、SiCl4的熔沸点都很低,可以判断出这两类物质都是分子晶体,熔融状态下不能电离出离子,所以不能导电,A正确;
B. MgCl2和NaCl的熔沸点都较高,可以判断出这两类物质都是离子晶体,熔融状态下可以电离出离子,所以能导电,且这两种物质都易溶于水,B正确;
C. R的熔沸点非常高,若其为原子晶体,则其熔沸点的高低是由共价键的键能决定的:共价键键能越高,该物质的熔沸点也越高,C正确;
D. 固态时可导电的不一定是金属晶体,比如石墨,石墨不是金属晶体,但是石墨可以导电,D错误;
故合理选项为D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目