��Ŀ����
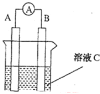
����Ŀ����1����ͼ��ʾ����CΪŨ���ᣬ������ָ�뷢��ƫת��B�缫����ΪFe ,A�缫����ΪCu����B�缫�ĵ缫��ӦʽΪ______________��A�缫�ĵ缫��ӦʽΪ ����Ӧ����һ��ʱ�����ҺC��pH�� (����ߡ������͡��������䡱)��
��2���ҹ��״�����������ˮ�����Ϊ��Դ�����͵ĺ�ˮ��־�ƣ��Ժ�ˮΪ�������Һ���������е�����ʹ����������������������ֻҪ�ѵƷ��뺣ˮ�����ӣ��ͻᷢ��ҫ�۵İ⡣���Դ�ĸ���������________��������ӦΪ___________��������ӦΪ_______________________��
��3�����ε�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ� ����Li2CO3��Na2CO3�������λ����������ʣ�COΪ����ȼ����������CO2�Ļ����Ϊ������ȼ�����Ƶ���650 ���¹�����ȼ�ϵ�أ�����йص�ط�Ӧʽ��������ӦʽΪ2CO��2CO32��4e��=4CO2��������ӦʽΪ________________________������ܷ�ӦʽΪ_________________________��
���𰸡���1��4H++ 2NO3-+2e-=2NO2+2H2O Cu-2e-= Cu2+ ����
��2���� 4Al��12e��=4Al3�� 3O2��6H2O��12e��=12OH��
��3��O2��2CO2��4e��=2CO![]() 2CO��O2===2CO2(2��)
2CO��O2===2CO2(2��)
��������
�����������1����CΪŨ���ᣬ����������Ũ����ۻ������ܼ�����Ӧ������ʱ������ָ�뷢��ƫת��B�缫����Ϊ���� ,A�缫����CuΪ�����������缫��ӦΪCu-2 e-= Cu2+��������ӦΪ4H++ 2NO3-+2e-=2NO2+2H2O����Ӧһ��ʱ�����ҺpH�����ߡ�
��2����������ˮ�����Ϊ��Դ�����ͺ�ˮ��־�ƣ�AlΪ����������������Ӧ��4Al-12e-=4Al3+�������е�����Ϊ��������������Ϊʯī���õ缫�Ϸ�����ԭ��Ӧ��3O2+6H2O+12e-�T12OH-��
��3����������ȼ�ϵ���У������������õ��ӺͶ�����̼��Ӧ����̼������ӣ��缫��ӦʽΪO2+2CO2+4e-�T2 CO32-��������ȼ��COʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼���缫��ӦʽΪ2CO+2 CO32--4e-�T4CO2���ڵ�ʧ������ͬ�����½��������缫��Ӧʽ��ӵõ�ط�Ӧʽ2CO+O2�T2CO2��

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�����Ŀ������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�������֪���±�����(25 ��)��
��ѧʽ | ����ƽ�ⳣ�� |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.4��10��7��K2��4.7��10��11 |
��1��25 ��ʱ����Ũ�ȵ�������Һ(A��NaCN��Һ��B��Na2CO3��Һ��C��CH3COONa��Һ)��pH�ɴ�С��˳��Ϊ__________________________��(��д���)
��2��25 ��ʱ����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ______ ___��
��3������Ũ��Ϊ0.02 mol/L��HCN��0.01mol/L NaOH�������Ϻ��c(Na+)��c(CN-)�����й�ϵ��ȷ���� ��
A��c(H+)��c(OH-) B��c(H+)��c(OH-)
C��c(H+)+c(HCN) = c(OH-) D��c(HCN)+ c(CN-)=0.01mol/L
��4��Ũ��Al2(SO4)3��Һ��Ũ��С�մ�(NaHCO3)��Һ��Ͽ�����������������ӷ�Ӧ����ʽ��ʾ����ԭ��_____________________��
��5����֪NaHC2O4ˮ��Һ�����ԣ���д������Һ�и�����Ũ�ȵĴ�С___________________��
