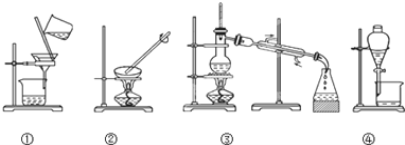
题目内容
【题目】实验室需1 mol·L-1的CuSO4溶液750 mL,配制时应选用的容量瓶的规格和称取CuSO4固体的质量分别为
A. 容量瓶:500 mL、250 mL各一个; CuSO4:共120.0 g
B. 容量瓶:750 mL、 CuSO4:120.0 g
C. 容量瓶:1 000 mL、CuSO4晶体:250.0 g
D. 容量瓶:1 000 mL、 CuSO4:160.0 g
【答案】D
【解析】实验室没有750mL的容量瓶,所以需要配制1000mL溶液,即需要1000mL容量瓶,需要硫酸铜的物质的量是1mol,质量是1mol×160g/mol=160g,答案选D。

【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g).已知常温常压下反应的能量变化如图1所示:  ②
②
化学键 | H﹣H | H﹣O | O=O |
键能kj/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280kJ/mol
O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ ![]() O2(g)=H2O(I)△H=﹣284kJ/mol
O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式;
(3)H﹣O的键能x值为;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL﹣1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL﹣1min﹣1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是 .
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)