题目内容
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g).已知常温常压下反应的能量变化如图1所示: 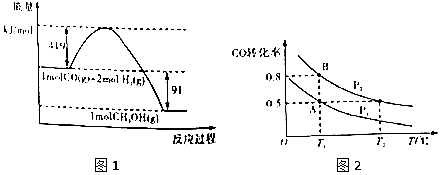 ②
②
化学键 | H﹣H | H﹣O | O=O |
键能kj/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280kJ/mol
O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ ![]() O2(g)=H2O(I)△H=﹣284kJ/mol
O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式;
(3)H﹣O的键能x值为;
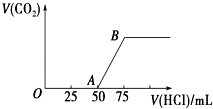
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL﹣1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL﹣1min﹣1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是 .
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
【答案】
(1)510
(2)CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJ?mol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJ?mol﹣1
(3)462
(4)7
(5)BC
【解析】解:(1)由图形可知甲醇的活化能为(419+91)kJ/mol=510kJ/mol,所以答案是:510;(2)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物. 由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=﹣91kJ/mol,
又已知:②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣280kJ/mol③H2(g)+
O2(g)═CO2(g)△H=﹣280kJ/mol③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣284 kJ/mol
O2(g)═H2O(l)△H=﹣284 kJ/mol
根据盖斯定律,③×2+②﹣①可得:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1 ,
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1 ,
所以答案是:CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1;(3)已知:H2(g)+
O2(g)=CO2(g)+2H2O(l)△H=﹣757kJmol﹣1;(3)已知:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣284 kJ/mol,
O2(g)═H2O(l)△H=﹣284 kJ/mol,
H2O(l)═H2O(g)△H=+44kJ/mol
二者相加可得:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣240 kJ/mol,
O2(g)═H2O(g)△H=﹣240 kJ/mol,
反应热=反应物总键能﹣生成物总键能,则436kJ/mol+ ![]() ×496kJ/mol﹣2×x kJ/mol=﹣240kJ/mol,解得x=462,
×496kJ/mol﹣2×x kJ/mol=﹣240kJ/mol,解得x=462,
所以答案是:462;(4)A、B两容器温度相同,即化学平衡常数相等,A点时转化率为50%,则K= ![]() =1,且B点时CO的转化率为0.8,则
=1,且B点时CO的转化率为0.8,则
CO(g)+ | 2H2(g) | CH3OH(g) | |
起始(mol) | 10 | 30 | 0 |
转化(mol) | 8 | 16 | 8 |
平衡(mol) | 2 | 14 | 8 |
设体积为VL,则有K= 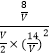 =1,V=7L,
=1,V=7L,
所以答案是:7;(5)A.丙为甲醇的分解是气体体积增大的反应,所以丙恒温恒压,体积变大,甲恒温恒容,体积不变,所以,V甲<V丙 , 故A错误;
B.合成甲醇是放热反应,其逆反应甲醇分解就是吸热的,乙绝热容器,丙恒温,所以乙反应后比丙温度低,向吸热方向进行的程度小,平衡时乙中甲醇浓度比丙高,CO和氢气浓度比丙低,K乙>K丙 , 故B正确;
C.条件相同时,甲与乙是等效平衡.甲与乙容器体积相同,乙分解甲醇吸热导致乙比甲温度低,平衡向合成甲醇方向移动,平衡时甲醇浓度乙大于甲,即c乙>c甲 , 故C正确;
D.甲与丙起始温度和起始体积相同,恒温条件下反应,丙在恒压条件下分解甲醇生成氢气和CO,平衡时体积比反应前大,即平衡时丙体积大于甲,则压强甲大于丙,所以υ甲>υ丙 , 故D错误.
所以答案是:BC.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案