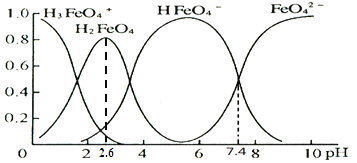
题目内容
【题目】下列叙述正确的是
A. c(NH4+)相等的NH4Fe(SO4)2溶液、NH4HCO3溶液、(NH4)2SO4溶液,溶质浓度大小关系是:c[(NH4)2SO4] <c[NH4HCO3] <c[NH4Fe(SO4)2]
B. 常温下下,0.1mol/LHC1溶液与等体积0.1mol/LBa(OH)2溶液混合后,溶液的pH=13
C. 0.lmol/L的NaHCO3 溶液中,c(H+)+c(H2CO3)=c(CO32-)+c(OH- )
D. 用惰性电极电解饱和氯化钠溶液: 2C1-+2H+![]() H2↑+ Cl2↑
H2↑+ Cl2↑
【答案】C
【解析】A. NH4Fe(SO4)2溶液中![]() 、Fe2+的水解相互抑制,NH4HCO3溶液中
、Fe2+的水解相互抑制,NH4HCO3溶液中![]() 、HCO3-水解互促,(NH4)2SO4溶液中
、HCO3-水解互促,(NH4)2SO4溶液中![]() 的下角标是2,题给离子的水解程度都很小,所以c(NH4+)相等的NH4Fe(SO4)2溶液、NH4HCO3溶液、(NH4)2SO4溶液,溶质浓度大小关系是:c[(NH4)2SO4]<c[NH4Fe(SO4)2]<c[NH4HCO3],故A错误;B. 常温下下,0.1mol/LHC1溶液与等体积0.1mol/LBa(OH)2溶液混合后,c(OH-)=(0.2-0.1)/2mol/L=0.05mol/L,溶液的pH≠13,故B错误;C. 0.lmol/L的NaHCO3溶液中,电荷守恒:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-),元素守恒:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),两等式消去c(Na+)得c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故C正确;D. 用惰性电极电解饱和氯化钠溶液:2Cl-+2H2O
的下角标是2,题给离子的水解程度都很小,所以c(NH4+)相等的NH4Fe(SO4)2溶液、NH4HCO3溶液、(NH4)2SO4溶液,溶质浓度大小关系是:c[(NH4)2SO4]<c[NH4Fe(SO4)2]<c[NH4HCO3],故A错误;B. 常温下下,0.1mol/LHC1溶液与等体积0.1mol/LBa(OH)2溶液混合后,c(OH-)=(0.2-0.1)/2mol/L=0.05mol/L,溶液的pH≠13,故B错误;C. 0.lmol/L的NaHCO3溶液中,电荷守恒:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-),元素守恒:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),两等式消去c(Na+)得c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故C正确;D. 用惰性电极电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,故D错误。故选C。
2OH-+H2↑+Cl2↑,故D错误。故选C。

【题目】草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
物质 | 熔点/℃ | 性质 |
H2C2O4 | 189.5 | 有毒,具有腐蚀性,易溶于水,二元弱酸,比醋酸酸性强,100℃开始升华,157℃时开始分解.草酸与浓硫酸混合加热产生CO2,CO和H2O.草酸钙和草酸氢钙均为白色难溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸与浓硫酸混合加热产物中含有CO2和CO(部分夹持仪器和加热装置省略)。

(1)仪器接口依次连接的合理顺序为a→____________________________.
(2)用上图提供的仪器和试剂做实验时,首次使用的装置B中出现白色浑浊,并不能说明草酸受热分解产物中一定有CO2,请你提出改进意见:__________________.
(3)利用改进后的装置进行实验时,要先加热______装置(填装置标号,下同)后加热______装置.
[实验二]利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中,迅速振荡混匀并开始计时,通过测定溶液褪色所需的时间来判断反应的快慢.该小组设计了如下的方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
1 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
2 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
3 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需满足的关系为n(H2C2O4)/n(KMnO4) ≥__________.
②探究温度对化学反应速率影响的实验编号是__________,探究反应物浓度对化学反应速率影响的实验编号是__________.
③已知50℃时c(MnO![]() )-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO
)-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO![]() )-t的变化曲线示意图并注明温度.
)-t的变化曲线示意图并注明温度.