题目内容
13.短周期元素X、Y、Z关系如图,X的电子层数为n,最外层电子数为2n,W原子内层电子数是最外层电子数的2倍,下列说法错误的是( )| X | |||
| Y | Z |
| A. | X和Y都是非金属元素,其中X最高化合价为+5 | |
| B. | X、W的最高价氧化物在一定条件下能反应 | |
| C. | 元素X、W和氧元素可形成化学式为W2XO3,离子化合物 | |
| D. | Y、Z的氢化物的稳定性Y<2 |
分析 短周期元素X、Y、Z,根据X、Y、Z在周期表中的位置知,X位于第二周期,Y和Z属于第三周期,X原子的电子层数为n,最外层电子数为2n,所以X原子的电子层数n=2,最外层电子数为4,所以X为C元素,根据这三种元素的位置知,Y是S元素、Z是Cl元素;W原子内层电子数是最外层电子数的2倍,则可能的排布为2、1或2、8、5,则W为Li或P元素,据此分析.
解答 解:短周期元素X、Y、Z,根据X、Y、Z在周期表中的位置知,X位于第二周期,Y和Z属于第三周期,X原子的电子层数为n,最外层电子数为2n,所以X原子的电子层数n=2,最外层电子数为4,所以X为C元素,根据这三种元素的位置知,Y是S元素、Z是Cl元素;W原子内层电子数是最外层电子数的2倍,则可能的排布为2、1或2、8、5,则W为Li或P元素.
A.X是C元素、Y是S元素,二者都是非金属元素,C元素最外层有4个电子,所以X最高化合价为+4价,故A错误;
B.X为C元素,W为Li或P元素,CO2与Li2O一定条件下能反应,故B正确;
C.元素C、Li和氧元素可形成化学式为Li2CO3,离子化合物,故C正确;
D.Y是S元素、Z是Cl元素,元素的非金属性越强,氢化物的稳定性越强,则稳定性:H2S<HCl,故D正确;
故选A.
点评 本题考查了元素位置结构性质的关系应用,正确推断元素是解本题关键,再结合物质的结构及性质来分析解答,题目难度不大.

练习册系列答案
相关题目
1.已知:NO2(g)+SO2(g)一定条件_SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3与NO的体积比保持不变 | D. | 每消耗1molSO2,同时生成1molNO |
18.煤气化过程中生成的CO和H2一定条件下制甲醇的反应如下:CO(g)+2H2(g)?CH3OH(g)△H<0.其他条件不变,改变某一条件后,用示意图表示的反应变化正确的是( )
| A | B | C | D | |
| 改变的条件 | 压强 | 温度 | 平衡体系增加H2 | 催化剂 |
| 变化的示意图 |  | 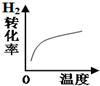 |  |  |
| A. | A | B. | B | C. | C | D. | D |
5.下面说法中正确的是( )
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
2.下列归类中,正确的是( )
| A. | Fe、Si--主族元素 | B. | Na2O2--碱性氧化物 | ||
| C. | 阿司匹林--抗酸药 | D. | 醋--调味剂和防腐剂 |
3.下列实验操作不正确或不能达到目的是( )
| A. | 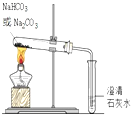 鉴别碳酸钠和碳酸氢钠 | B. | 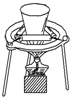 钠的燃烧 | ||
| C. | 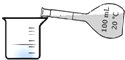 量取100.00mL溶液 | D. | 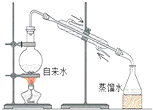 实验室制取蒸馏水 |
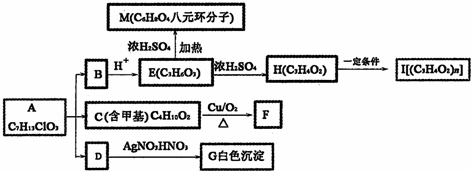
 +O2
+O2 +2H2O;②E→M:2HOCH2CH2COOH
+2H2O;②E→M:2HOCH2CH2COOH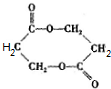 +2H2O;
+2H2O;